摘要;血管内皮糖萼是覆盖在血管内皮上的带有负电荷的绒毛状结构, 是血管内皮与血浆之间的天然屏障, 主要起调节血管的通透性、调节炎症反应 (白细胞的黏附与流动) 、转导血管机械剪切力、抑制血管内凝血等作用, 本文阐述了糖萼的结构、生理功能、影响因素及保护方面的相关研究进展。
关键词:血管内皮糖萼; 炎症反应; 血管通透性; 凝血功能; 药物保护;
作者简介: 凌斌, E - mail: lingbin_icu@ 163. com;
收稿日期:2018-10-16
基金: 国家自然科学基金资助项目 (编号:81360289); 云南省科技厅-昆明医科大学联合专项资金项目 (编号:2015FB079, 2017FE467 (-194) , 2017FE468 (-180) );
Received: 2018-10-16
血管内皮糖萼也称多糖包被, 是一层20nm左右的淡蓝色荧光物质, 由Luft于1966年在电镜下直接观察到[1]。目前已有大量的实验证明, 糖萼的脱落与炎症反应、动脉粥样硬化、糖尿病等一系列疾病的病理生理过程有关, 通过研究糖萼的结构、功能及其保护方法, 有助于对微循环病理生理改变的理解。
1 糖萼的结构及功能
1.1 糖萼的结构
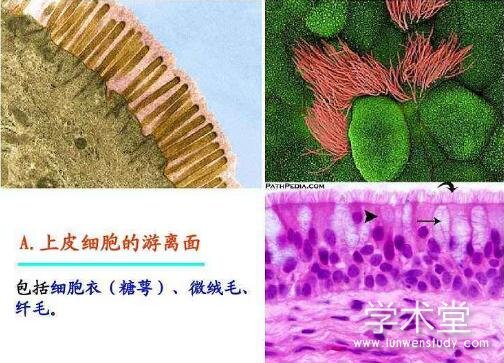
糖萼层是一个动态的天然屏障, 介于管壁和血液之间。主要由蛋白聚糖、糖胺聚糖、膜糖蛋白及血浆蛋白组成, 其中蛋白聚糖和糖胺聚糖是其主要组成部分[2]。
蛋白聚糖包括多配体聚糖-1 (Syndecan-1) 、磷脂酰肌醇聚糖及唾液酸。其中Syndecan-1作为核心蛋白通过跨膜结构域依附在血管内皮上, 并与硫酸乙酰肝素 (heparin sulfate, HS) 和硫酸软骨素 (chondroitin sulfate, CS) 相连接[2], 这种结构参与了血管内皮剪切力的转导[3];而磷脂酰肌醇聚糖则是通过糖基化磷脂酰肌醇锚定在内皮细胞上, 同时与HS相连, 构成了糖萼的“骨架”。
糖胺聚糖 (glycosaminoglycans, GAGs) 的成分主要包括:HS作为GAGs的主要成分, 约占蛋白聚糖总量的50%以上。而CS和HS通常以1∶4的比例存在, 因糖萼中GAGs的表达依赖于各种刺激, 如内皮细胞活化或刺激等, 可导致这个比例变化[2]。糖胺聚糖中的透明质酸 (hyaluronic acid, HA) 主要与CD44相连接, 在维持血管内皮的完整性中起重要作用[4]。
血浆蛋白、糖蛋白这些可溶性分子均镶嵌在蛋白聚糖和GAGS所构成的结构中[5]。
1.2 糖萼的功能
作为血管内皮的屏障, 糖萼在调节血管的通透性、调节炎症反应、转导血管机械剪切力、抗凝等起着重要作用[2]。
1.2.1 调节血管通透性
糖萼调整血管通透性受多种因素影响, Vink等[6]检测了内皮细胞表面层 (endothelial cell surface layer, ESL) 对不同血浆标记分子的通透性, 发现分子量大的中性及阴离子分子不能透过ESL, 同时分子量小的中性分子比阴离子渗透快, 而纤维蛋白原与血浆白蛋白移动速率相同, 此发现提示改变糖萼层的电荷密度可能会对血管壁的通透性造成直接影响。另有研究, 用免疫荧光法标记大鼠肠系膜微血管内皮细胞膜和糖萼, 再利用成像技术分析出糖萼的厚度 (0.17~3.02μm) , 同时用神经氨酸酶灌注破坏内皮糖萼中的唾液酸残基可降低内皮糖萼的厚度并增加白蛋白的渗透性, 说明糖萼中的唾液酸也有调节血管通透性的作用[5]。
1.2.2 参与力的传导
内皮细胞能够在力的作用下可通过细胞信号转导生成一氧化氮 (nitric oxide, NO) 调节血管张力, 其传导途径有多种。据报道[2], 糖萼在血管内皮中对力的信号传导有重要作用, 尤其是对血管剪切力的影响。Florian等[7]首次通过动物实验发现当硫酸肝素的浓度降到一定程度时, 可完全阻断剪切力诱导的NO生成, 证实糖萼参与力的传导。近期研究表明[8], 内皮糖萼能够感应并转换垂直机械力产生NO, 这种快速的NO产生依赖于糖萼中HS和HA, 因此去除HS或HA可导致NO产生显着降低, 此外, 内皮细胞可通过瞬时受体电位 (TRP) 通道摄取Ca2+引起NO的释放。
1.2.3 调节炎症反应
选择素、白细胞介素等细胞因子可协助白细胞翻转移位在介导炎症反应中起重要作用。研究表明, GAGS中的HS可作为L-选择素的配体[9], 参与白细胞在血管内的白细胞翻转移位[10], 另外, HS可调节趋化因子的浓度梯度从而使内皮细胞和白细胞紧密黏附。Wang等[11]发现, 将大鼠的HS基因敲除后可减少血管内皮趋化因子的聚集及黏附。此外, 近期研究发现[12], 由炎症引发的糖萼脱落可进一步促进单核细胞黏附和促进脂质潴留的巨噬细胞浸润。
1.2.4 抗凝作用
血管内皮糖萼作为重要的内皮屏障, 生理情况下可避免内皮与血细胞直接接触, 从而避免血栓形成。另外, 糖萼还可与抗凝血酶Ⅲ、血栓调节素和组织因子途径抑制物 (TFPI) 相互作用达到抗凝作用。其主要机制包括: (1) 抗凝血酶Ⅲ与糖萼上的硫酸乙酰肝素相结合增强其抗凝作用; (2) 血栓调节蛋白能与硫酸软骨素相结合, 能够转化凝血酶为蛋白C通路的激活剂, 从而形成抗凝途径; (3) TFPI是凝血通路中FⅦa和FⅩa的有效抑制剂, 主要是通过硫酸乙酰肝素与糖萼相互作用达到抗凝作用[13]。
2 糖萼的脱落因素
目前已知糖萼脱落的因素有多种, 其中包括动脉粥样硬化、糖尿病、炎症反应、缺血再灌注等, 这些因素可导致血液中syndecan-1、HS等糖萼降解的重要标志物增多[13,14], 从而导致血管通透性增加、凝血功能异常等病理生理情况。
2.1 动脉粥样硬化
粥样斑块的形成与内皮细胞损伤有关, 其中糖萼层的脱落可导致内皮细胞暴露在各种危险因素下, 促进斑块形成。Van den Berg等[15]在研究脂质喂养的小鼠时, 发现小鼠颈内动脉 (动脉粥样硬化易发区) 的窦区的内皮糖萼层的尺寸显着小于颈总动脉处, 提示糖萼的减少及脂质的沉积与该处的流体剪切力紊乱有关。另外, 炎症引发的糖萼脱落可促进单核细胞黏附和泡沫细胞浸润, 从而促进斑块形成[12]。动脉粥样斑块的形成已证实与糖萼脱落有关, 糖萼脱落也成为心血管疾病研究的一大热点。
2.2 糖尿病
糖尿病相关的微血管和大血管并发症严重影响糖尿病患者的预后和病死率, 良好的血糖控制可降低微血管疾病发生率。Nieuwdorp等[16]发现1型糖尿病患者的全身糖萼量明显减低, 伴有微量蛋白尿或处于急性高血糖的患者, 血管内糖萼下降更明显。Nieuwdorp等[17]还发现高血糖可促进体内透明质酸酶的合成, 而有动物实验[18]发现后者可抑制糖萼HA降解, 导致糖萼破坏。
2.3 炎症反应
血管内皮糖萼是炎症反应作用于血管最早侵及的部位, 在多种炎症反应中已经证明了糖萼功能的快速丧失与炎症有关[19]。炎性条件下, 炎性细胞释放大量的酶和反应性物质, 可能导致糖萼损伤。其中, 活化的嗜中性粒细胞可通过产生活性氧和氮类物质 (ROS/RNSs) 介导其储存颗粒中的蛋白酶释放导致糖萼损伤[20], ROS/RNS不仅对糖萼造成直接损伤, 还可通过诱导金属蛋白酶 (MMP) 的激活和内源性蛋白酶抑制剂的失活而加强糖萼的蛋白水解[19]。此外, 肥大细胞可以直接释放乙酰肝素酶, 具有通过降解HS破坏糖萼结构的潜力。近期研究发现[21], 登革病毒 (DENV) 非结构蛋白1 (NS1) 可破坏人类肺微血管内皮细胞上的EGL, 其主要机制是通过诱导唾液酸酶和乙酰肝素酶的表达从而引起唾液酸降解和硫酸乙酰肝素的脱落。
2.4 缺血再灌注
研究表明缺血再灌注损伤可导致糖萼脱落, 虽然不同组织之间的缺血再灌注损伤程度不同, 但共同点是微血管功能障碍。Brueggeretal等[22]通过豚鼠心脏缺血再灌注发现内皮源性血管舒张与内皮糖萼破坏相关。另外, 通过阻断黄嘌呤氧化还原酶可以减弱缺血再灌注对糖萼的影响, 提示氧化应激与糖萼脱落相关[23]。
3 糖萼的保护因素
3.1 NO
NO是血管细胞的重要信号分子, 低水平的NO可以防止氧化细胞损伤。Brueggeretal等[22]发现在没有酶促反应破坏糖萼时, 再灌注期间施用NO对糖萼具有保护作用。
3.2 蛋白酶抑制剂
凝血酶等蛋白酶已被证实参与多配体聚糖胞外域的切割, 抑制蛋白酶活性可起到保护糖萼的作用, 所以蛋白酶抑制剂的治疗用途具有可能性。研究表明[24], 通过抑制单核细胞趋化蛋白-1可影响巨噬细胞组织蛋白酶L分泌, 从而减少糖萼降解酶乙酰肝素酶的激活。另外研究表明, 抗凝血酶可防止肿瘤坏死因子 (TNF) -α和心脏缺血再灌注引起的糖萼的脱落[25]。
3.3 TNF-α信号抑制剂
TNF-α是炎症发展的关键介质之一, 临床使用TNF-α信号传导抑制剂可显着减少内毒素引起的糖萼成分脱落、凝血激活和功能性血管功能紊乱[26]。
3.4 糖皮质激素
有学者认为糖皮质激素可抑制糖萼脱落, 其糖萼保护机制可能与抑制肥大细胞脱颗粒相关。氢化可的松对内皮细胞有直接保护作用, 还可以抑制免疫效应细胞。研究表明, 在孤立的心脏模型中, 氢化可的松预处理可显着减少缺血再灌注和TNF-α诱导炎症引起的糖萼脱落[25]。
3.5 挥发性麻醉药
七氟醚可通过对血细胞及血管内皮的抗炎保护作用预防缺血再灌注损伤。有实验表明, 七氟醚可直接作用于内皮细胞, 通过七氟醚预处理可保护血管内皮糖萼, 降低趋化因子表达[27]。
3.6 降低高血糖或高胆固醇血症
合理而有效地控制血糖和血脂可防止糖萼的脱落。有研究发现, 瑞舒伐他汀治疗家族性高胆固醇血症患者后, 患者体内的糖萼量有所回升[28]。
3.7 其他保护性药物
肝素及其衍生物可通过减少HS和syndecan-1的水平达到保护糖萼的作用。另外, 舒洛地特作为糖萼的补充剂, 可补充HS, 还具有抗炎作用, 可防止糖萼脱落。
4 展望
血管内皮糖萼作为血液与内皮的天然屏障, 在机体中起着诸如调节血管通透性、转导剪切力、抗凝、调节炎症反应等重要作用。目前关于糖萼的研究主要是糖萼的结构、功能, 及其损伤、保护和监测等, 其保护方式局限, 往往是对原发病的治疗。因糖萼的损伤因素复杂, 如炎症、糖尿病、动脉粥样硬化、缺血再灌注等, 也就意味着糖萼的保护不能通过单一药物完成, 需要从糖萼的补充、防脱以及改善可能导致糖萼脱落的环境如 (高血糖、高血脂) 等方面着手进行研究, 从而找到更多对糖萼有保护作用的药物和方法。
参考文献
[1] Luft JH.Fine structures of capillary and endocapillary layer as revealed by ruthenium red[J].Fed Proc, 1966, 25 (6) :1773-1783.
[2] Reitsma S, Slaaf DW, Vink H, et al.The endothelial glycocalyx:composition, functions, and visualization[J].Pflugers Arch, 2007, 454 (3) :345-359.
[3] Koo A, Dewey CF Jr, García-Cardena G.Hemodynamic shear stress characteristic of atherosclerosis-resistant regions promotes glycocalyx formation in cultured endothelial cells[J].Am J Physiol Cell Physiol, 2013, 304 (2) :C137-C146.
[4] Lennon FE, Singleton PA.Hyaluronan regulation of vascular integrity[J].Am J Cardiovasc Dis, 2011, 1 (3) :200-213.
[5] Betteridge KB, Arkill KP, Neal CR, et al.Sialic acids regulate microvessel permeability, revealed by novel in vivo studies of endothelial glycocalyx structure and function[J].J Physiol, 2017, 595 (15) :5015-5035.
[6] Vink H, Duling BR.Capillary endothelial surface layer selectively reduces plasma solute distribution volume[J].Am J Physiol Heart Circ Physiol, 2000, 278 (1) :H285-H289.
[7]Florian JA, Kosky JR, Ainslie K, et al.Heparan sulfate proteoglycan is a mechanosensor on endothelial cells[J].Circ Res, 2003, 93 (10) :e136-e142.
[8] Dragovich MA, Chester D, Fu BM, et al.Mechanotransduction of the endothelial glycocalyx mediates nitric oxide production through activation of TRP channels[J].Am J Physiol Cell Physiol, 2016, 311 (6) :C846-C853.
[9] Koenig A, Norgard-Sumnicht K, Linhardt R, et al.Differential interactions of heparin and heparan sulfate glycosaminoglycans with the selectins.Implications for the use of unfractionated and low molecular weight heparins as therapeutic agents[J].J Clin Invest, 1998, 101 (4) :877-889.
[10]Hemmerich S, Bistrup A, Singer MS, et al.Sulfation of L-selectin ligands by an HEV-restricted sulfotransferase regulates lymphocyte homing to lymph nodes[J].Immunity, 2001, 15 (2) :237-247.
[11] Wang L.Heparan Sulfate Proteoglycan in Inflammation and Angiogenesis[M]∥Glycans in Diseases and Therapeutics[M].Berlin:Springer Berlin Heidelberg, 2011:1-29.
[12] Cancel LM, Ebong EE, Mensah S, et al.Endothelial glycocalyx, apoptosis and inflammation in an atherosclerotic mouse model[J].Atherosclerosis, 2016, 252:136-146.
[13] Kozar RA, Pati S.Syndecan-1 restitution by plasma after hemorrhagic shock[J].J Trauma Acute Care Surg, 2015, 78 (6 Suppl1) :S83-S86.
[14] Ikeda M, Matsumoto H, Ogura H, et al.Circulating syndecan-1predicts the development of disseminated intravascular coagulation in patients with sepsis[J].J Crit Care, 2017, 43:48-53.
[15] van den Berg BM, Spaan JA, Rolf TM, et al.Atherogenic region and diet diminish glycocalyx dimension and increase intima-tomedia ratios at murine carotid artery bifurcation[J].Am J Physiol Heart Circ Physiol, 2006, 290 (2) :H915-H920.
[16] Nieuwdorp M, Mooij HL, Kroon J, et al.Endothelial glycocalyx damage coincides with microalbuminuria in type 1 diabetes[J].Diabetes, 2006, 55 (4) :1127-1132.
[17] Nieuwdorp M, van Haeften TW, Gouverneur MC, et al.Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo[J].Diabetes, 2006, 55 (2) :480-486.
[18] DognéS, Rath G, Jouret F, et al.Hyaluronidase 1 Deficiency Preserves Endothelial Function and Glycocalyx Integrity in Early Streptozotocin-Induced Diabetes[J].Diabetes, 2016, 65 (9) :2742-2753.
[19] Becker BF, Chappell D, Bruegger D, et al.Therapeutic strategies targeting the endothelial glycocalyx:acute deficits, but great potential[J].Cardiovasc Res, 2010, 87 (2) :300-310.
[20]van Golen RF, van Gulik TM, Heger M.Mechanistic overview of reactive species-induced degradation of the endothelial glycocalyx during hepatic ischemia/reperfusion injury[J].Free Radic Biol Med, 2012, 52 (8) :1382-1402.
[21] Puerta-Guardo H, Glasner DR, Harris E.Dengue Virus NS1Disrupts the Endothelial Glycocalyx, Leading to Hyperpermeability[J].PLo S Pathog, 2016, 12 (7) :e1005738.
[22] Bruegger D, Rehm M, Jacob M, et al.Exogenous nitric oxide requires an endothelial glycocalyx to prevent postischemic coronary vascular leak in guinea pig hearts[J].Crit Care, 2008, 12 (3) :R73.
[23] Rubio-Gayosso I, Platts SH, Duling BR.Reactive oxygen species mediate modification of glycocalyx during ischemia-reperfusion injury[J].Am J Physiol Heart Circ Physiol, 2006, 290 (6) :H2247-H2256.
[24] Boels MGS, Koudijs A, Avramut MC, et al.Systemic Monocyte Chemotactic Protein-1 Inhibition Modifies Renal Macrophages and Restores Glomerular Endothelial Glycocalyx and Barrier Function in Diabetic Nephropathy[J].Am J Pathol, 2017, 187 (11) :2430-2440.
[25]Chappell D, Jacob M, Paul O, et al.The glycocalyx of the human umbilical vein endothelial cell:an impressive structure ex vivo but not in culture[J].Circ Res, 2009, 104 (11) :1313-1317.
[26]Nieuwdorp M, Meuwese MC, Mooij HL, et al.Tumor necrosis factor-alpha inhibition protects against endotoxin-induced endothelial glycocalyx perturbation[J].Atherosclerosis, 2009, 202 (1) :296-303.
[27] Casanova J, Simon C, Vara E, et al.Sevoflurane anesthetic preconditioning protects the lung endothelial glycocalyx from ischemia reperfusion injury in an experimental lung autotransplant model[J].J Anesth, 2016, 30 (5) :755-762.
[28] Meuwese MC, Mooij HL, Nieuwdorp M, et al.Partial recovery of the endothelial glycocalyx upon rosuvastatin therapy in patients with heterozygous familial hypercholesterolemia[J].J Lipid Res, 2009, 50 (1) :148-153.





