在农业生产中由害虫造成的损失占农作物损失总量的15%以上,因此害虫防治是农业生产中的一项重要任务。昆虫病微生物及其代谢产物已成为生物农药的重要组成部分。苏云金芽胞杆菌(Bacil-lus thuringiensis,Bt)是目前世界上研究最为深入、应用面积最广、且应用最成功的杀虫微生物。自Schnepfand Whiteley分离克隆了第1个Bt杀虫晶体蛋白基因(cry基因)至今,已经克隆了620个cry基 因,cry1类 基 因 数 目 最 多,占244种。
cry1I基因是一类十分特殊的cry1类基因,该类基因编码蛋白只有81kD,不同于大多数Cry1蛋白的130kD。已公布的cry1I类基因主要为cry1Ia、cry1Ib、cry1Ic等6类共50种,其中cry1Ib类有11种。Tailor等从Bt菌株4835中克隆了第1个cry1I基因cry1Ia1,发现其对鞘翅目的马铃薯甲虫(Leptinotarsa decemlineata)和鳞翅目的欧洲玉米螟(Ostrinia nubilalis)具有毒杀活性。后来发现的cry1Ia基因对鞘翅目昆虫均未表现活性。迄今为止,所发现的cry1I基因所表达的杀虫蛋白主要对鳞翅目夜蛾科 (Noctuidae)、卷叶蛾科(Tortri-cidae)、菜蛾科(Plutellidae)和鞘翅目叶甲科(Chry-somelidae)的 害 虫 表 现 出 杀 虫 活 性。 另 外,cry1I类基因在Bt菌株中多数是沉默的,如cry1Ia1基因在菌株4835中就未见表达产物。
cry1I基因沉默的主要原因可能是,其基因编码区上游与cry1类基因相邻,形成cry1-cry1I连锁,造成了cry1I基因自身启动子的缺乏。
近年来的研究发现,cry1I类基因除了具有较强的杀虫活性和相对较广的杀虫谱,其表达产物与Cry1A类蛋白无交互抗性,这将为解决Bt毒素杀虫谱较窄、害虫抗药性产生等问题,提供新的备选基因,因此,cry1I类基因的研究具有重要的理论意义和实用价值。
GS8是本实验室自行分离的野生菌株,经PCR-RFLP鉴定含有cry1Ib基因。本研究克隆了该基因,对其进行了序列比对分析,并在大肠杆菌中进行了表达,测定了其基因表达产物对几种主要农业害虫的活性,发现该基因对小菜蛾(Plutella xylostella)具有高毒力。
1材料和方法
1.1材料
1.1.1 菌株与质粒所用菌株和质粒见表1.
1.1.2 培养基 LB液体培养基:Tryptone 1.0%,Yeast extract 0.5%,NaCl 1.0%,pH 7.0。LB固体培养基:在液体LB培养基中加入1.2%琼脂粉。
1.1.3酶和生化试剂PCR相关试剂购自上海生工。限制 性 内 切 酶、T4 DNA ligase、DNA Frag-ment Purification Kit均购自Promega公司。
1.1.4供试昆虫甜菜夜蛾(Spodoptera exigua)、棉 铃 虫 (Helicoverpa armigera)和 粉 纹 夜 蛾(Trichoplusia ni)均由河北农业大学昆虫病理与分子生物学实验室提供;小菜蛾(Plutella xylostella)由河北省植物保护研究所提供;家蚕(Bombyx mori)品种为菁松×皓月,购于山东广通蚕种集团有限公司。榆兰叶甲(Pyrrhalta aenescens)采集于野外。
1.2方法
1.2.1 Bt质粒的提取采用改进的CTAB方法,参见文献[15]。cry1I基因PCR-RFLP鉴定、Bt cry基因和阳性转化子的筛选参考宋福平等方法。
1.2.2 大肠杆菌分子克隆与检测 E.coli质粒DNA提 取、DNA酶 切、连 接、转 化、表 达 产 物 和SDS-PAGE检测参照文献[15]。
1.2.3 Bt GS8菌株中的cry1Ib基因的PCR扩增、克隆和表达参考GenBank中公布的cry1Ib类基因编码区的5'端和3'端序列,设计引物:
以GS8的质粒DNA为模板,利用高保真DNA聚合酶进行PCR扩增。
PCR反应条件:94 ℃预变性4min;94 ℃变性1min;56.5 ℃退火1min;72℃延伸1min 40s,32个循环;最后72 ℃延伸10min。回收PCR产物,将目的片段用BamHⅠ和SalⅠ进行双酶切,与以同样酶切处理过的pET21b进行连接,转化大肠杆菌TG1,以PCR和限制性酶切筛选获得阳性重组克隆。
1.2.4 cry1Ib基因测序和分析选取阳性重组克隆进行序列测定,DNA测序工作由上海生工生物工程技术服务有限公司完成,采用DNAMAN、DNA-SIS等软件和ExPASy数据库分析序列。
1.2.5 cry1Ib基因在大肠杆菌中表达将含有cry1Ib全长基因的重组质粒导入大肠杆菌BL21(DE3),以IPTG进行诱导,获得cry1Ib基因的正常表达。诱导条件参见Novagen公司产品说明。
1.2.6 Cry1Ib蛋白杀虫生物活性测定棉铃虫、粉纹夜蛾和甜菜夜蛾采用饲料表面覆盖法进行生物测定:将饲料平铺于20cm2小盒底部,然后将100μL菌液均匀涂布于饲料表面,风干,每盒10头试虫,重复5次。置于26.5℃培养箱中,每24h检查一次活虫数量(以不能顺利进入2龄视为死亡)。家蚕和小菜蛾采用浸液法,将待测菌株按预先设计好的浓度,用无菌水稀释,用清水作为阴性对照。将新鲜叶片清洗,晾干;分别在Bt菌液中浸润10s取出,晾干,放入广口瓶中(每片叶柄裹无菌水浸湿的脱脂棉进行叶片保鲜);每瓶接虫10头(每个处理10头虫,5次重复)初孵幼虫。放入25℃光照培养箱培养,分别于72h后进行调查。榆兰叶甲参见张杰等方法。测定结果用Abbott公式计算死亡率。LC50和95%置信应用POLO软件计算得出。
2结果和分析
2.1全长cry1Ib基因的扩增及克隆
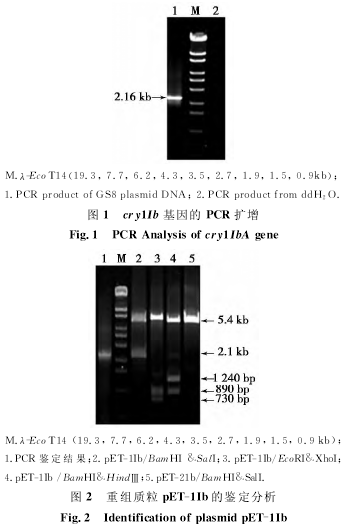
以GS8菌株质粒DNA为模板,用上述引物进行PCR扩增(图1),再经限制性酶切和测序鉴定,证明该菌株含有cry1Ib的基因。通过PCR扩增,从GS8菌株克隆到全长为2.16kb cry1Ib全长基因,经BamHⅠ和SalⅠ酶切插入表达载体pET-21b中,获得重组质粒命名为TpET-1Ib(图2)。
2.2序列测定及分析
将TpET-1Ib进行测序得到cry1Ib基因的全长 片 段 核 苷 酸 序 列,在GenBank登 录 号 为EU677422,并由国际Bt-δ-内毒素基因命名委员会命名为cry1Ib3。推测了该基因由719个氨基酸组成,氨 基 酸 组 成 分 析 表 明 亮 氨 酸 (Leu)、丝 氨 酸(Ser)和苏氨酸(Thr)含量最高,分别为8.90%,8.62%,7.93%;该蛋白预测分子量为81.372kDa,等电点为pI 6.215,属于弱酸性蛋白。
通过vector NTI软件分析,结果表明,该蛋白与已公布的6种Cry1Ib蛋白的氨基酸序列存在差异(表2),是一种新的Cry1Ia蛋白,2009年国际Bt杀虫晶体蛋白命名委员会将其命名为Cry1Ib3。
通过用NCBI Conserved Domain Databas分析Cry1Ib3保守结构域,结果表明,其DomainⅠ是由N端第60~280位、共221个氨基酸残基组成,Do-mainⅡ由第287~497位、共211个氨基酸残基组成,DomainⅢ由第507~644位、共138个氨基酸残基组成,因此,Cry1Ib3蛋白的活性区估计应位于N端的第60~644个氨基酸残基区域(见图3)。
利用同源建模方法构建了Cry1Ib3蛋白的三级结构,显示如图5。
2.3 cry1Ib3基因的表达
将阳性克隆重组质粒TpET-1Ib转化到大肠杆菌BL21(DE3)中,经过诱导获得正常表达。对诱导1~24h的目的蛋白样品进行SDS-PAGE分析,可见约81kD的目的蛋白随诱导时间的延长,蛋白表达量 逐 渐 增 多,到 第6小 时 达 到 最 大,经Im-ageMaster 2DPlatinum软件分析,约占总蛋白的45%,同时有65kDa的蛋白产生(见图5)。
2.4杀虫生物活性测定
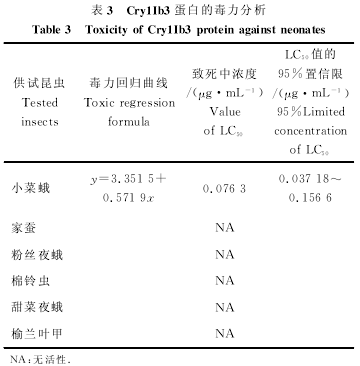
由pET21b表达的Cry1Ib3蛋白对小菜蛾有很强的杀虫活性,LC50值为0.076 3μg/mL,对其它试虫没有活性(见表3)。
3讨论与结论
本研究利用PCR-RFLP体系,在野生菌株GS8中鉴定出cry1Ib基因。在此基础上,从GS8中克隆了cry1Ib基因,并在大肠杆菌中成功的表达了81kD的重组蛋白。cry1Ib3基因表达产物经SDS-PAGE分析,发现为多条带,产物并不是单一的,分析其编码区序列发现,同一读码框下,不同的起始密码子共用一个终止子,可能是由于在不同起始密码子处翻译所致,也有可能是由于表达蛋白自然降解所致,这有待于进一步研究。而用cry1Ib3表达产 物 对 供 试 昆 虫 进 行 生 物 活 性 测 定,发 现Cry1Ib3蛋白对重要的蔬菜害虫小菜蛾显示了高毒力,而对棉铃虫、甜菜夜蛾、粉纹夜蛾、家蚕和榆兰叶甲等未表现出杀虫活性。据报道,由于蛋白自身结构的差异,81kD的Cry1I类与Cry1Ab等130kD的Cry1A类蛋白不存在交互抗性。因此,本研究发现的cry1Ib3新基因将为我国抗虫转基因作物和工程菌的研制,提供新的基因来源,为筛选、延缓和克服昆虫产生抗性的基因组合提供了重要材料,具有重要的理论和实践意义。
国内外的研究结果证明cry1I类基因在野生菌株中通常是沉默的,如cry1Ia基因在功株4835中就没有表达产物。在cry1I基因编码区上游一般与cry1类基因相邻,称为cry1-cry1I连锁,造成了cry1I基因自身启动子的缺乏,这种现象在Bt菌株中普遍存在,是cry1I基因沉默的主要原因。
由此以杀虫活性来筛选菌株的传统方法无法发现该类基因的存在。实际上,cry1I类基因广泛存在于Bt菌株中。无论是第1个克隆的对鳞翅目和鞘翅目害虫具有双重活性cry1Ia基因,还是宋福平等克 隆 的cry1Ie基 因以 及 本 实 验 室 克 隆 的cry1Ib3基因,该类沉默基因表达产物均对鳞翅目等害虫具有很高的活性,目前,一些cry1I类基因正应用于抗虫转基因植物的研制。研究结果表明,作为重要杀虫微生物的Bt菌株而言,其沉默基因资源有着巨大的研究潜力,引起了国内外学者们的关注,有望成为今后Bt研究新的热点。
参考文献:
[1]Schnepf H E,Whiteley H R.Cloning and Expres-sion of the Bacillus thuringiensis Crystal ProteinGene in Escherichia coli[J].Proc Nati Acad Sci,1981,78(5):2893-2897.
[2]http://www.lifesci.sussex.ac.uk/home/Neil_Crick-more/Bt/toxins2.html.
[3]Crickmore N D,Zeigler R,Feitelson J,et al.Revi-sion of the nomenclature for the Bacillusthuringien?sispesticidal crystal proteins[J].Microbiology andmolecular biology reviews,1998,62:807-813.
[4]Tailor R J,Tippett G,Gibb,et al.Identifieation andcharacterization of a novel Bacillus thuringinsis delta-endotoxin entomocidal to coleopteran and lepidopteranlarvae[J].Mol Microbiol,1992,6:1211-1217.
[5]Choi S K,Shin B S,Kong E M,et al.Cloning of anew Bacillus thuringiensis crylI-type Crystal Pro-tein gene[J].Curr Microbiol,2000,41:65-69.
[6]Sekar V,Held B,Tippett J,et al.Biochemical andmolecular characterization of the insecticidal frag-ment of CryV[J].Applied and Environmental Mi-crobiology,1997,63(7):2798-2801.
[7]Angamuthu S,Vanga S R,Kumar P A,et al.Trans-formation of Nicotiana tabacum with a native cry1Ia5gene confers complete protection against Heliothis ar-migera[J].Molecular Breeding,1998,4:473-478.
[8]Song F P,Zhang J,Gu A X,et al.Identification ofcry1I-type genes gene from Bacillus thuringiensisstrains and characterization of a novel cry1I-typegene[J].Applied and Environmental Microbiology,2003,69(9):5207-5211.
[9]Escudero I R,Estela A,Porcar M,et al.Molecularand insecticidal characterization of a Cry1Iprotein toxicto insects of the families Noctuidae,Tortricidae,Plute-llidae and Chrysomelidae[J].Applied and Environmen-tal Microbiology,2006,72(7):4796-4804.
[10]Diego H S,Jorge S,Alejandra B,et al.Toxicity ofBacillus thuringiensis δ-endotoxins against beanshoot borer(Epinotia aporema Wals.)larvae,a ma-jor soybean pest in Ar gentina[J].Journal of Inver-tebrate Pathology,2007,94:125-129.
[11]Kostichka K,Warren G W,Mullins M,et al.Clo-ning of a cryV-type insectieidal protein gene fromBa-cillus thuringiensis the cryV-eneoded Protein is ex-pressed early in stationary phase[J].J Bacteriol,1996,178:2141-2144.
[12]宋福平,张杰,顾爱星,等.苏云金芽胞杆菌cry1I基因沉默 的 研 究 [J].自 然 科 学 进 展,2002(12):934-938.
[13]Tounsi S,Zouari N,Jaoua.Cloning and study of theexpression of a novel cry1Ia-type gene fromBacillusthuringiensis subsp kurstaki[J].Journal of AppliedMicrobiology,2003,95:23-28.
[14]刘廷辉,郭巍,申建茹.苏云金芽胞杆菌GS8菌株的生物学 特 性 及cry基 因 型 鉴 定 [J].农 药 学 学 报,2009,11(1):92-97.
[15]Sambrook J,Fritschand E F,Maniatis T.Molecularcloning,A laboratory manual[M].2ndedition.NewYork:Cold Spring Harbor Laboratory Press,2002.
[16]宋福平,张杰,黄大昉,等.苏云金芽胞杆菌cry基因PCR-RFLP鉴定体系的建立[J].中国农业科学,1998,31(3):13-18.
[17]郭巍.粉纹夜蛾对苏云金芽胞杆菌Cry1Ac的抗性及其防御体系的研究[D].广州:中山大学,2005.
[18]Zhao J Z,Cao J,Li Y X,et al.Transgenic PlantsExpressing Two Bacillus thuringiensis Toxins DelayInsect Resistance Evolution[J].Nature Biotechnolo-gy,2003,21(12):1493-1497.
[19]张杰,宋福平,李长友,等.对鞘翅目害虫高毒力Bt基因cry3Aa7的分离克隆及表达研究[J].中国农业科学,2002,35(6):650-653.
[20]Abbott W S.A Method of Computing the Effective-ness of an Insectcide[J].J Econ Entomol,1925,18:265-267.
[21]宋福平.苏云金芽孢杆菌cry1le1和cry8基因的研究[D].北京:中国农业科学院,2003.
[22]刘金环,薛静,宋福平,等.苏云金芽胞杆菌BtC008杀虫晶体蛋白基因鉴定、克隆及杀虫活性分析[J].植物保护,2006,32(6):22-26