摘要:目的 :探讨细胞自噬对口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)上皮间质转化(epithelial-mesenchymal transition, EMT)的影响。方法:采用不含营养物质的汉克斯平衡盐溶液培养人OSCC细胞系CAL27 6 h,诱导自噬。用Western印迹法检测CAL27细胞自噬水平的变化。用Western印迹法和免疫荧光技术检测CAL27细胞EMT相关指标的变化。光镜下观察CAL27细胞形态的变化。结果:经过饥饿诱导自噬后,CAL27细胞自噬水平增高,EMT相关指标发生了变化,细胞形态变成了纺锤样间质细胞。结论:自噬能促进OSCC发生EMT。
关键词:口腔鳞状细胞癌; 自噬; 上皮间质转化;
Autophagy Promotes Epithelial-mesenchymal Transition in Oral Squamous Cell Carcinoma
CHEN Yang SHANG Zhengjun
The State Key Laboratory Breeding Base of Basic Science of Stomatology, Hubei Province & Key Laboratory of Oral Biomedicine, Wuhan University,Ministry of Education
Abstract:Objective: To explore the effect of autophagy on epithelial-mesenchymal transition(EMT) of oral squamous cell carcinoma(OSCC). Methods: Human OSCC cell line CAL27 was cultured for 6 h with Hank′ s balanced salt solution(HBSS) containing no nutrients and serum to induce autophagy. Western blot was used to detect the autophagy level of CAL27 cells. Western blot and immunofluorescence were used to detect EMT-related markers of CAL27 cells. The morphology of CAL27 cells was observed under light microscope. Results: After starvation-induced autophagy, the level of autophagy in CAL27 cells increased, the EMT-related markers changed, and the cell morphology changed to spindle-like mesenchymal cells. Conclusion: Autophagy can promote the EMT of OSCC. 口腔鳞状细胞癌(OSCC)来源于口腔黏膜鳞状分化的上皮细胞,是口腔颌面部最常见的恶性肿瘤,以高度局部浸润性及易发生颈部淋巴结转移为特征,其常规治疗手段为手术切除并辅以放化疗[1]。细胞自噬是真核细胞利用溶酶体对细胞器及蛋白质进行降解的过程,以达到自我更新、维持稳态的目的。根据溶酶体接受待降解物质的不同方式,细胞自噬主要有3种形式:微自噬、巨自噬和分子伴侣介导的自噬。其中巨自噬最为常见,也是通常意义上的自噬,其特征为具有自噬体的形成[2]。越来越多的研究表明,细胞自噬与肿瘤的发生、发展有关[3]。上皮间质转化(EMT)是指上皮细胞失去极性及细胞间黏附,向间质细胞转化的现象,其与恶性肿瘤的侵袭、转移密切相关[4]。然而,现阶段关于自噬与EMT的关系在OSCC中尚不清楚。本研究尝试探索其中的机制,为实现OSCC精准靶向治疗提供依据。
1 材料和方法
1.1 材料
人OSCC细胞系CAL27购买于美国模式培养物集存库(ATCC);主要试剂:E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)抗体购于美国CST公司;p62、Beclin1、波形蛋白(Vimentin)抗体、荧光二抗购于武汉三鹰公司。
1.2 饥饿处理
在培养皿上接种合适数量的OSCC细胞CAL27,使用完全培养基培养至细胞密度为70%左右时,更换完全培养基为汉克斯平衡盐溶液,继续培养6 h。使用完全培养基培养的细胞为正常组,中途使用汉克斯平衡盐溶液进行换液处理的细胞为饥饿组。
1.3 Western印迹法
蛋白上样量为30μg/孔。电泳:浓缩胶内采用60 V,30 min;分离胶内采用120 V,70 min。转膜:采用恒流200 m A,90 min。室温下5%脱脂牛奶封闭2 h。TBST溶液漂洗,加入一抗于4℃下孵育过夜。第2天用TBST溶液洗3次,每次10 min。加入二抗置室温下孵育1 h。TBST溶液洗3次,每次10 min。发光液孵育3 min后使用成像仪成像。
1.4 细胞免疫荧光实验
弃去原有培养基,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗3次,多聚甲醛固定10 min。PBS洗3次,加入3%牛血清白蛋白(bovine serum albumin,BSA)置室温封闭1 h。加入一抗,4℃过夜孵育。PBS洗3次,加入荧光二抗,37℃孵育30 min。PBS洗3次,加入4′,6-二脒基-2-苯基吲哚(DAPI)染色1 min。PBS洗3次后于荧光显微镜下观察,拍照。
2 结果
2.1 饥饿后CAL27细胞自噬水平增强
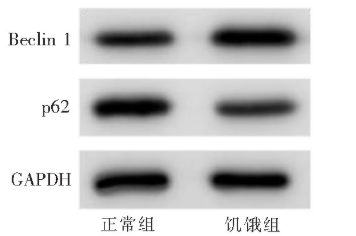
Western印迹法结果显示,使用汉克斯平衡盐溶液培养CAL27细胞6 h后,与未进行饥饿处理的细胞相比,饥饿组细胞中p62的表达降低,Beclin1的表达增高(图1),表示饥饿组自噬水平增高。
2.2 自噬增强的CAL27细胞发生了EMT
为探讨自噬对EMT的影响,对CAL27细胞进行EMT相关指标的检测。结果显示,自噬增强后,其E-钙黏蛋白下降,N-钙黏蛋白及波形蛋白表达升高(图2),且细胞形态变成纺锤样间质细胞(图3)。结果证明CAL27细胞在自噬增强后发生了EMT。
图1 饥饿6 h后,Western印迹法显示CAL27细胞自噬相关蛋白Beclin及p62水平的变化
Figure 1 Western blot analysis of expression of Beclin 1 and p62 of autophagy in CAL27 cells after starvation for 6 h
图2 饥饿6 h后,CAL27细胞EMT相关指标的变化
Figure 2 The changes of EMT-related markers of CAL27 cells after starvation for 6 h
注:A.应用免疫荧光技术检测EMT相关指标的改变(×400);B.应用Western印迹法检测EMT相关指标的变化。
图3 饥饿6 h后,CAL27细胞形态学的改变(×200)
Figure 3 The change of morphology of CAL27 cells after starva-tion for 6 h (×200)
注:A.正常组;B.饥饿组。
3 讨论
OSCC是全世界排名第8的恶性肿瘤[5]。尽管近年来OSCC在诊断和治疗策略等方面取得了巨大进展,但由于其易于复发和转移,患者的总体5年生存率仅为50%左右[6]。细胞自噬指部分需要降解的细胞内容物被运送到溶酶体进行消化的过程,其主要功能是提供细胞存活需要的能量,维持细胞稳态,实现细胞的自我更新[2]。细胞自噬受到一系列自噬相关蛋白的调节,在饥饿及其他应激条件下,Bcl-2与Beclin1相互解离后,将自噬活化信号向下传递,导致微管相关蛋白轻链3与p62/SQSTM1聚合物结合,促进自噬小体的形成和待降解物质的降解,此过程表现为Beclin1的升高及p62的降低[7]。细胞自噬在肿瘤的发生、发展过程中扮演着不同的甚至是自相矛盾的角色[8]。在肿瘤发生的早期,细胞自噬可以抑制肿瘤的发生,抑制细胞自噬能够促进肿瘤的增长[9]。但是,在肿瘤的进展过程中,细胞自噬可以增强肿瘤细胞的放化疗抵抗能力,维持肿瘤细胞的氧化代谢活动,抑制肿瘤细胞凋亡[10]。
EMT过程中上皮细胞极性消失,细胞间黏附性降低,细胞形态变为纺锤样间质细胞形态,细胞的迁移和侵袭能力增强。此外,EMT相关分子的表达也会发生变化,表现为E-钙黏蛋白表达降低,N-钙黏蛋白和波形蛋白表达增高[11]。研究证明,EMT与多种肿瘤的侵袭和转移密切相关[12,13]。
细胞自噬参与了EMT并具有促进和抑制EMT的双重作用。有学者发现,Beclin1的减少能引起自噬抑制,可以活化胃癌细胞中的低氧诱导因子-1a(hypoxia inducible factor-1a,HIF-1a),诱导EMT的发生[14]。也有学者发现,上调AEG-1基因可以诱导自噬的持续激活,使肝癌细胞TGF-β1自分泌水平上调,并通过激活转化生长因子-β(transforming growth factor-β,TGF-β)/Smad3信号通路促进肝癌细胞EMT的发生[15]。
但目前为止,细胞自噬与EMT在OSCC中的相关机制尚不清楚。本研究饥饿诱导CAL27细胞发生自噬,Western印迹法证明其自噬水平增高。随后利用Western印迹法和免疫荧光技术检测其EMT相关指标的变化,发现CAL27细胞发生自噬后,其E-钙黏蛋白表达量降低,N-钙黏蛋白和波形蛋白表达量增高,且细胞形态转变为纺锤样间质细胞形态。由此推断,自噬的激活可以促进OSCC细胞发生EMT,使用特异性自噬抑制剂可以阻止肿瘤细胞发生EMT,这为OSCC的临床治疗提供了新的思路。
参考文献
[1] 张志愿,余光岩.口腔颌面外科学[M]. 7版.北京:人民卫生出版社,2013:324-325.
[2] Kondratskyi A, Kondratska K, Skryma R, et al. Ion channels in the regulation of autophagy[J]. Autophagy, 2018,14(1):3-21.
[3] Dower CM, Wills CA, Frisch SM, et al. Mechanisms and context underlying the role of autophagy in cancer metastasis[J]. Autophagy, 2018, 14(7):1110-1128.
[4] Aiello NM, Kang YB. Context-dependent EMT programs in cancer metastasis[J]. J Exp Med, 2019, 216(5):1016-1026.
[5] Siegel R, Ward E, Brawley O, et al. Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer J Clin, 2011, 61(4):212-236.
[6] Pulte D, Brenner H. Changes in survival in head and neck cancers in the late 20th and early 21st century:a period analysis[J]. Oncologist, 2010, 15(9):994-1001.
[7] Bhattacharya A, Wei Q, Shin JN, et al. Autophagy is required for neutrophil-mediated inflammation[J]. Cell Rep,2015, 12(11):1731-1739.
[8] Folkerts H, Hilgendorf S, Vellenga E, et al. The multifaceted role of autophagy in cancer and the microenvironment[J]. Med Res Rev, 2019, 39(2):517-560.
[9] Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J].Nature, 1999, 402(6762):672-676.
[10] Hu YL, DeLay M, Jahangiri A, et al. Hypoxia-induced autophagy promotes tumor cell survival and adaptation to antiangiogenic treatment in glioblastoma[J]. Cancer Res,2012, 72(7):1773-1783.
[11] Mittal V. Epithelial mesenchymal transition in tumor metastasis[J]. Annu Rev Pathol, 2018, 13:395-412.
[12] Pastushenko I, Blanpain C. EMT transition states during tumor progression and metastasis[J]. Trends Cell Biol,2019, 29(3):212-226.
[13] 李傲楠,田慧,顾客,等.过表达TAZ促进口腔舌鳞癌细胞增殖迁移和侵袭的作用机制研究[J].口腔颌面外科杂志, 2018, 28(4):192-197.
[14] Qin WJ, Li C, Zheng W, et al. Inhibition of autophagy promotes metastasis and glycolysis by inducing ROS in gastric cancer cells[J]. Oncotarget, 2015, 6(37):39839-39854.
[15] 邓伟杰.自噬对肝癌细胞侵袭转移潜能的作用及机制研究[D].上海:第二军医大学, 2012.