近年来关于维生素C对表观遗传层面的影响研究
时间:2014-11-07 来源:未知 作者:傻傻地鱼 本文字数:5983字
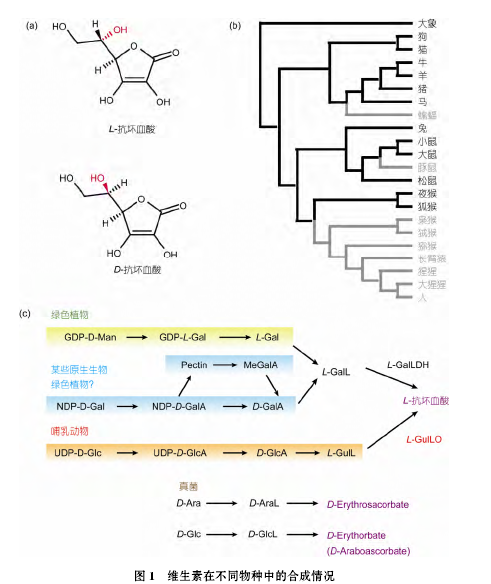
在 15 世纪至 18 世纪, 远洋航行的水手们由于长时间得不到新鲜蔬菜水果的供给, 会出现牙齿松动、牙龈出血、肌肉酸痛无力以及皮下出血等症状, 严重的情况下会致人死亡, 这种疾病被命名为坏血病. 在人类几百年来与坏血病对抗的过程中, 维生素 C 的存在逐渐被证明. 直到 1928 年, 生化学家 AlbertSzent-Gyorgyi 首次成功分离维生素 C. 之后, Szent-Gyorgyi 和化学家 Walter H. Haworth 通过对维生素 C性质及分子式的分析, 将维生素 C 重新命名为抗坏血酸(ascorbic acid). 根据手性的不同, 抗坏血酸分为 L-和 D-型(图 1(a)), 维生素 C 为 L-抗坏血酸, 天然存在于生物体内的也为 L-抗坏血酸.
虽然维生素 C 对人类而言是必需的重要维生素之一, 但除了硬骨鱼类、某些鸟类、灵长类、蝙蝠和豚鼠外, 大多数的脊椎动物具备自己合成维生素 C的能力. 人类无法合成维生素 C, 原因是人体合成维生素 C 最后一步的酶——古洛糖酸内酯氧化酶L-GulLO (L-gulonolactone oxidase)缺失. 在进化过程中, 维生素 C 的合成部位经历了由肾脏到肝脏的转变, 其中鱼类、两栖类、爬行类和一部分的鸟类是在肾脏完成维生素 C 的合成; 另外一部分的鸟类和哺乳类则是在肝脏中完成. 植物可以自己合成大量维生素 C, 这为许多动物提供了体内维生素 C 的来源;酵母也具有维生素 C 的合成能力, 但是酵母、植物和动物合成维生素 C 的途径却有所不同(图 1(c)). 本文从介绍维生素 C 的生理功能开始, 重点聚焦近几年来发现的维生素 C 对表观遗传层面的影响, 讨论维生素 C 如何通过影响细胞的表观遗传修饰从而改变细胞命运.
1 、维生素 C 的生理功能
维生素 C 在动物体内有着重要的生理功能. 缺乏维生素 C 将导致坏血病, 其原因之一是体内胶原的合成和成熟受阻, 胶原由重复的结构 Gly-X-Y 组成, 其中 X 和 Y 代表脯氨酸(Pro)与 4-羟基脯氨酸(4-Hyp). 4-Hyp 是脯氨酸衍生物, 它的缺乏会导致胶原无法维持正常结构. 体内的脯氨酸羟化酶(prolyl-4-hydroxylase)需要维生素 C 存在的条件下才能正常发挥作用. 维生素 C 还在合成神经递质以及肉毒碱的合成中起作用. 作为体内的重要抗氧化剂之一,它也参与许多低氧反应. 不同器官对维生素 C 的需求不同, 维生素 C 的吸收和利用主要由其受体辅助进行. 目前研究表明, SVCT1 (sodium coupled Vcco-transporters 1)和 SVCT2 是大鼠、小鼠以及人体中的维生素 C 受体, 其中 SVCT1 主要是上皮细胞吸收维生素 C 的受体; SVCT2 分布在神经元、内分泌系统以及骨组织等地方. 虽然大多数的哺乳动物能够合成维生素 C, 但是受体的缺乏也会带来重要的影响. Sotiria 等人的研究表明, Slc23a1(编码 SVCT2的基因)缺失会导致新生小鼠立即死亡, 死亡的原因为呼吸系统衰竭以及脑部出血. Slc23a1–/–的小鼠具有合成维生素 C 的能力, 但由于受体的缺失, 无法在组织器官里正常富集, 因而表现出严重症状.
维生素 C 在动物体内的重要性, 从它依赖金属离子以及a-酮戊二酸(α-ketoglutarate, 2OG)的双加氧酶类(dioxygenases)的辅酶作用便可以窥见一斑, 前文提及的脯氨酸羟化酶便属于该类酶. 在双加氧酶的反应中, 维生素 C 是维持酶活必不可少的因素, 它负责电子传递, 及时将反应生成的 Fe4+还原形成 Fe2+,而其自身被氧化形成脱氢抗坏血酸(dehydroascorbate,DHA)(图 2(a)). 这类酶中, 许多都是通过双加氧的途径完成去甲基化过程, 之中又有很大一部分和表观遗传调控直接相关, 如组蛋白赖氨酸去甲基化酶(lysine demethylases, KDMs)和 DNA 去甲基化酶(图2(b)), 因此维生素 C 对于生命活动的影响可能有更加广泛的生物学意义. 维生素 C 还是一种重要的细胞培养的添加成分, 在胚胎干细胞(embryonic stemcells, ESCs)的培养中, 一种代替血清的培养基 KOSR(knockout serum replacement)中, 含有较高的 L-抗坏血酸; 用添加了维生素 C 的培养基培养细胞, 细胞的DNA 去甲基化水平会提高. 在诱导体细胞重编程过程中添加维生素 C, 可以提高重编程效率, 并且可以提高得到的 iPSC 克隆质量.
2、 维生素 C 与组蛋白/DNA 去甲基化酶
前文提到维生素 C 会影响表观遗传修饰相关的组蛋白赖氨酸去甲基化酶和 DNA 去甲基化酶, 因而参与细胞的表观遗传调控过程, 这是维生素 C 值得注意的一个新功能. 在多细胞生物中, 同一套遗传物质可以表现为多种表达模式或细胞类型, 这种调控一般是通过组蛋白、DNA 等遗传物质上的共价修饰来实现的, 这种调控称之为表观遗传调控, 是决定细胞功能的重要开关. 在这些修饰中, 组蛋白上赖氨酸残基的甲基化及 DNA 胞嘧啶的 5 位甲基化, 扮演着重要的角色. 例如, 常见的组蛋白 H3 赖氨酸修饰有K4, K9 和 K27 等, 其中 H3K4me3 被作为转录激活的标志, H3K9me3 和 H3K27me3 则与基因表达沉默、X染色体失活等相关. DNA胞嘧啶5位的甲基化同样在基因表达调控中起到重要作用, 如基因组 DNA 上存在一些区域, 富含胞嘧啶(C)和鸟嘌呤(G), 这段区域被称为 CpG岛(CpG islands), 哺乳动物基因的启动子区域常常存在 CpG 岛, 它们的胞嘧啶的甲基化程度往往与该基因表达的活跃程度成反比.
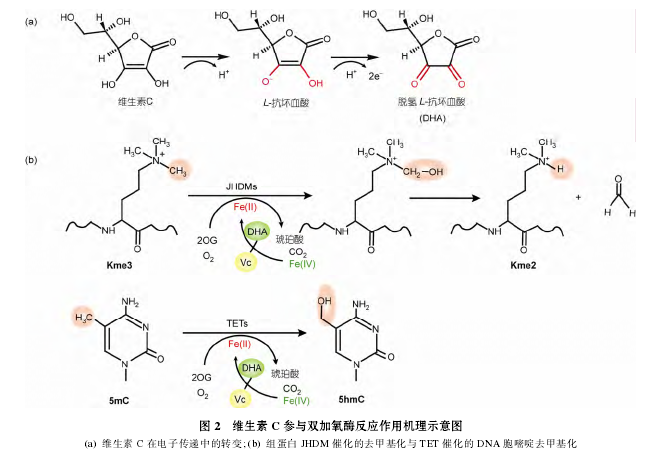
已知的组蛋白赖氨酸去甲基化酶可以分为依赖于黄素(flavin)的组蛋白去甲基化酶和依赖于 Fe2+和2OG、含有 Jumonji C (JmjC)结构域的双加氧酶. 前一种酶主要包括 H3K4me1/2 和 H3K9me1/2 的去甲基化酶 LSD1 和 LSD2; 而后一种酶则包括了大多数的H3K4/9/27 的去甲基化酶, 这些酶不仅可以催化单甲基化和二甲基化, 三甲基化也可以作为它们的反应底物. 在催化反应过程中, 维生素 C 作为辅酶, 将Fe4+还原形成 Fe2+(图 2). 含有 Jumonji 结构域的蛋白被分成了许多亚类, 不同的亚类具有不同的识别和催化位点. 一般来讲, JmjC 结构域具有保守的 2 个组蛋白残基和 1个谷氨酸残基, 它们负责螯合金属离子;具有 JmjC 结构域的蛋白通常含有其他的结构域, 如可以识别组蛋白修饰的 PHD, Tudor 结构域以及可以识别 DNA 的 ARID 和 CXXC 结构域, 这两者相互配合, 不同的组蛋白去甲基化酶就展现出了各自的特性.
在对 DNA 胞嘧啶甲基化的探索中, 早期的研究表明DNMT家族的蛋白催化DNA胞嘧啶的甲基化反应, 而对于去甲基化过程的认识却停留在通过 DNA复制引发的被动去甲基化. 2009 年, Tahiliani 等人通过对锥虫中 JBP 蛋白的比较, 发现在哺乳动物中存在 TET1, TET2 和 TET3 三种同源蛋白(paralogousproteins), 这 3 种蛋白的结构类似, 都具有半胱氨酸富集区(Cys-rich)以及 DSBH 结构域, 是一类依赖于Fe2+和 2OG 的双加氧酶. 它们可以将细胞中的 5-甲基胞嘧啶(5-methylcytosine, 5mC)氧化形成 5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC). 进一步的研究发现, TET (ten-eleven translocation)家族蛋白可以将 5hmC 继续氧化形成 5-甲酰基胞嘧啶(5-formylcy-tosine, 5fC) 和 5- 羧基胞嘧啶 (5-carboxylcytosine,5caC), 最后在糖基化酶 TDG (thymine DNA gly-cosylase)的作用下, 利用碱基切除修复(base-excisionrepair, BER)途径完成 DNA 的主动去甲基化. TET蛋白介导的主动去甲基化在哺乳动物个体的繁殖和发育过程中有重要作用. Gu 等人的研究表明,TET3 参与到受精过程中精子的主动去甲基化 ;Hackett 等人的研究发现, 生殖细胞的去甲基化和印记基因的擦除是依赖于 TET1 与 TET2 产生的 5-羟甲基胞嘧啶. 此外, TET 家族蛋白在胚胎干细胞中的作用也得到研究人员的关注.
目前研究证明, 维生素 C 可以促进 TET 介导的5-甲基胞嘧啶的氧化. 在 Yin 等人的研究中, 通过提高维生素 C 的浓度, 可以促进 TET 体外以及细胞内的酶活, 增加 5hmC 和 5fC 的产生量; 该研究还证明了维生素 C 可以与 TET 的催化域结合. 在小鼠胚胎干细胞(mESCs)的培养过程中添加维生素 C, 同样可以检测到 5hmC 水平的升高, 但是 Tet1/Tet2–/–的mESCs 却基本检测不到 5hmC 的存在, 暗示 mESCs中 5mC 的去甲基化是由 TET1 和 TET2 完成, 而表达量较少的 TET3 可能对 mESCs 的影响较小. 早期Chung 等人对人胚胎干细胞(hESCs)的研究中发现,在培养过程中添加维生素 C, 会特异性的提高 1847种基因的去甲基化, 其中一部分基因 CpG 岛的甲基化水平的降低导致基因表达的变化. 最近, Blaschke等人的研究发现, 维生素 C 可以影响小鼠胚胎干细胞中 TET 蛋白的活性, 提高 mESCs 基因组整体5hmC 水平 , 以及一些生殖系相关的基因如 Asz1,Dazl 等基因启动子的 hmC 水平, 并促进这些基因的表达, 使胚胎干细胞表现出囊胚样的状态. 另外有研究报道, 维生素 C 可以通过促进 JAK/STAT2 信号通路中 STAT2 的磷酸化程度, 促进 Nanog 表达,维持胚胎干细胞的多能性网络. 另一方面, 维生素 C还可以帮助胚胎干细胞抵抗 RA引起的分化, 以及L-Pro 引起的间充质样细胞转变的过程. 维生素 C对细胞的影响, 不仅仅表现在对胚胎干细胞上. Mi-nor 等人在小鼠胚胎成纤维(MEF)的培养过程中添加维生素 C, 也可以观察到 5hmC 水平的提高. 由于MEF 中 TET1 与 TET2 表达量比较低, 这个羟甲基化的过程很有可能是由 TET3 介导的.
除了上面介绍的这2种酶, AlkB蛋白家族作为一种重要的依赖于 Fe2+和 2OG 的双加氧酶, 在表观遗传调控中也有重要作用. AlkB 蛋白在细菌的DNA 损伤修复中发挥作用, 在人体内至少有 9 种AlkB 蛋白家族的成员 , 分别是 ALKBH1-8 (又名ABH1-8)和 FTO. 其中 E. coli 中的 AlkB 蛋白、人的ALKBH2 蛋白以及 TET2 蛋白的蛋白结构已知 .
AlkBH 家族可以参与到多种 DNA 以及 RNA 的修饰修复中, 如 1mA, 3mC, 1mG, 以及 3mT; FTO 是这个家族中有趣的成员, 据报道与人类的肥胖有关,而且除了可以参与 3mT 的修复外, 还是一种 RNAm6A 的去甲基化酶. 虽然目前维生素 C 对 AlkBH家族的影响尚未知晓, 但是从维生素 C 在双加氧酶发挥酶活作用中举足轻重的地位可以推测, 这将会是个重要的研究内容.
3、 维生素 C 与重编程
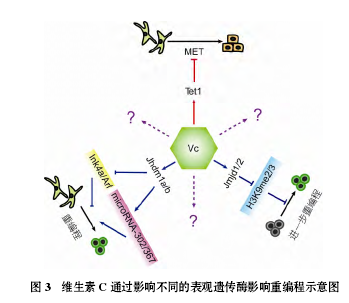
近年来, 维生素 C 在细胞重编程, 特别是诱导多能性干细胞(induced pluripotent stem cells, iPSCs)方面(图 3), 给我们带来了许多新的惊喜和疑问.
iPSCs 技术出现初期因诱导效率低 (~0.001%~0.0001%)和使用了原癌基因 c-Myc 而受到许多质疑,因此寻找更加安全、高效的诱导方式成为许多科学家研究的方向. 在众多的提高 iPSCs 诱导效率的方法中,在诱导培养基中添加维生素 C 的方法崭露头角. 2010年, Esteban等人在研究中发现, 维生素C可以提高OCT4/SOX2/KLF4/c-Myc (OSKM)以及 OCT4/SOX2/KLF4 (OSK)的重编程效率. 维生素 C 起初被认为作为一种抗氧化剂而起到了促进重编程的效率, 但是其他的抗氧化剂如还原型谷胱甘肽、维生素 B1 和亚硒酸钠等并没有显著促进重编程的效果, 表明维生素 C 对重编程的促进作用远非是通过减少细胞 ROS起作用. 接下来的研究发现, 维生素 C 可以抑制重编程过程中 P53 和 P21 蛋白的表达, 从而帮助细胞绕过衰老的路障. Wang 等人之后的研究发现, 维生素 C可以影响组蛋白 H3K36me2/3 的去甲基化酶 Jhdm1a/1b. Jhdm1b 能够抑制 Ink4/Arf 位点, 从而抑制细胞衰老并且促进细胞增殖; 另一方面, JHDM1b 通过与OCT4 的相互作用, 激活了参与干细胞多能性调控网络的 mircoRNA 302/367 基因簇. 维生素 C 通过影响组蛋白去甲基化酶活性, 对重编程造成了影响.
另一方面, Stadtfeld 等人在研究 B 细胞重编程时发现, 诱导重编程培养基中加入维生素 C 可以防止印记基因位点Dlk1-Dio3印记的丢失. Dlk1-Dio3位点是位于小鼠第 12 条染色体的父本印记位点, 之前的研究表明, 该位点印记丢失的小鼠 iPS 细胞无法形成具有四倍体互补能力的“all-iPS”细胞. 维生素 C加入之后, 促进该位点的 IG-DMR 形成 H3K4me3,从而阻止了 Dnmt3a 对该位点的甲基化修饰, 保护了Meg3 (又名 Glt2)的正常表达.
在小鼠重编程的过程中, 会产生一种形态类似iPS 细胞, 但是内源多能调控网络并未激活的细胞,这种细胞可以在外源基因没有沉默的情况下进行自我更新, 并且可以稳定传代建立细胞系, 这一类被阻滞在重编程道路上的细胞, 被称为 pre-iPSCs.
Esteban 等人的研究发现, 维生素 C 可以促进pre-iPSCs 向 iPSCs 的转变, 但是其作用机理并不清楚. 最近, Chen 等人的研究发现, 组蛋白 H3K9 的甲基化是造成 pre-iPSCs 形成的主要原因. 在重编程的诱导过程中, 血清中含有的骨形成蛋白家族(BMPs), 能够作用于其下游的 H3K9 甲基转移酶, 从而阻碍了重编程的进行; 另一方面, 如果在培养基中添加维生素 C, 则可以通过激活 KDM3/4 等 H3K9 的去甲基化酶来重新激发重编程过程. 虽然不同的pre-iPSCs 具有很大的异质性, 但是在培养过程中加入维生素 C, 对于激活 pre-iPSCs 中的多能调控网络,将其重新引向重编程的道路是十分行之有效的方法.
综上所述, 维生素 C 通过影响组蛋白的修饰, 从而影响重编程的过程让我们对维生素 C 在细胞命运中所起到的作用有了全新的认识; 而最近在研究DNA 去甲基化酶 TET 蛋白在重编程过程中的作用,维生素 C 又为我们带了戏剧性的一幕. 研究表明,TET1 和 TET2 能够促进体细胞重编程, TET1 甚至可以取代 OCT4, 形成 TET1/SOX2/KLF4/C-MYC (TSKM)的 iPSCs. 然而, 当诱导培养基中添加了生理浓度的维生素 C(~76.5 μmol/L, 小鼠血浆浓度)之后, TET1 对重编程的作用由促进变成了抑制. 造成这种转变的原因是由于 TET1 酶活的增强, 抑制了重编程早期的间充质-上皮转化(MET)过程; 由于TET1 酶活增强而带来的 TET1 催化位点是否发生了改变, 还有待进一步的研究.
4、 讨论与展望
维生素 C 在维持生物个体健康与细胞正常培养状态的机理具有多样化, 它参与生化反应, 维持着代谢与调控之间的稳态, 特别是在表观遗传调控方面,如果这其中的平衡被打破, 生物体极有可能患代谢或是癌症之类的疾病. 维生素 C 还是儿茶酚胺类物质合成不可缺少的物质, 多巴胺、去甲肾上腺素和肾上腺素是体内重要的神经递质和激素, 它们控制着人体的代谢以及情绪; 另一方面, TET 蛋白家族在神经系统中的高表达引发我们思考 DNA 主动去甲基化是否与记忆、认知的形成相关联, 而维生素 C 直接与这些重要的生命现象相关, 更加体现了它对于生命体的重要性. 此外, 维生素 C 作为一种重要的抗氧化剂, 能够清除体内产生的活性氧(ROS). 低氧压力会诱导低氧诱导因子(HIF)的产生、提高 P53 的表达. 低氧条件是胚胎干细胞以及许多成体干细胞的生长环境, 对体细胞重编的影响也较为复杂. Yoshida 等人早期实验表明, 采用 5%的低氧条件能够提高小鼠以及人的 iPS 诱导效率; 最近研究发现低氧条件下产生的 HIF1α 与 HIF2α 在重编程的不同时期起到不同作用, 因此推测, 低氧条件下维生素 C 有可能通过间接影响了 HIF, ROS, P53 等与细胞代谢或是衰老相关的途径影响体细胞的重编程.
在漫长的生物进化过程中, 包括人在内的一些动物对于维生素 C 合成能力丧失, 虽然其中原因目前尚未知晓, 但由于生存环境中富含维生素 C 食物的繁多, 并没有被自然选择所淘汰. 维生素 C 对人体健康的作用一度成为有争议的话题, 维生素 C 被认为能够预防感冒, 并且能提高机体的免疫力, 甚至能够抵抗癌症的发生. 虽然这些观点的正确性以及其背后的作用机理有待研究, 但是这个神奇的小分子足以给我们带来许多健康和惊喜.
- 相关内容推荐





