
西伯利亚白刺( Niraria sibirica) 是我国白刺属植物中分布范围最广的一种,除西北地区外,在东北和华北地区也有分布[1 -3],具有耐干旱、耐严寒、耐高温、耐盐碱和抗风沙等特性,适应环境能力极强,果实富含花青素,其生态和资源价值成为经济开发的备选目标,因此有必要进行深入研究[4 -5].花青素为天然水溶性色素,属黄酮类化合物,是植物中广泛存在的一大类天然多酚化合物的总称[6],主要聚集于植物的花卉、果实及有色叶片等部位.花青素作为一种天然食用色素,安全、无毒、资源丰富,具有一定营养和药理作用,在食品、化妆品、医药等方面有着巨大的应用潜力.随着对天然产物活性研究的不断进展,大量研究表明,花青素类化合物具有抗自由基、改善视力、预防心血管疾病、提高认知能力、抗肿瘤、抗突变等活性[7 -8].
目前,白刺属植物果实中花青素组分的生物学功能已经引起了人们的关注,但针对西伯利亚白刺果实的研究尚不多.本研究采用高效液相色谱串联质谱方法,对产自内蒙古西部地区的西伯利亚白刺果实花青素成分进行了系统分析与鉴定,为进一步丰富对白刺属植物资源的开发利用提供科学依据.
1 材料和方法
1. 1 植物材料及试剂
西伯利亚白刺果实采自库布齐沙地北缘的独贵塔拉( 40°45'N,108°60'E,海拔1 060 m) 和乌兰布和沙地南缘的吉兰泰( 39°70'N,105°70'E,海拔 1 100 m) .果实于 2012 年 7 月和 8 月间,分别采集未成熟的黄色果实、半成熟的红色果实和完全成熟的紫色果实.采集时随机选取 3 株白刺植株,并摘取不同高度枝条上的果实,果实迅速存于保鲜箱中,使用冰袋降温,24 h 内转入 -80 ℃冰箱储存.
试剂: 甲醇和乙腈( 色谱级) 购自美国飞世尔公司( Fisher Scientific,USA) .甲酸( 色谱级) 购自上海安谱科技公司,三氟乙酸( TFA,色谱级) 购自德国默克公司( Merck,Darmstadt,Germany) .HPLC 级水由 Milli-Q 超纯水系统制备( Millipore,Billerica,MA,USA) .分析级甲醇和甲酸购自北京化工公司.花青素标准品: 矢车菊素 3-葡萄糖苷( Cyanidin 3-O-glucoside chloride,纯度≥98% ) 购自成都普思生物科技公司,用于花青素定量分析.
1. 2 方法
1. 2. 1 花青素的提取 西伯利亚白刺果实花青素的提取方法参照 Zheng 等[9]方法略修改.取西伯利亚白刺紫果、红果以及黄果各若干,去核,匀浆,各称取 20 g 果浆,加入 10 mL 甲醇溶液( 含 2% 甲酸) ,室温避光提取 24 h,重复3 次,合并3 次离心后的上清液,用滤纸过滤除去蛋白质、不溶物以及多糖.再经 0. 22 μm 尼龙有机滤膜过滤后,用于定性和定量分析.
1. 2. 2 花青素的定性分析 采用 Agilent 1100 LC /MSD Trap XCT plus 液质联用仪进行花青素定性分析.电离源类型为 ESI,选择正离子模式全扫描和自动二级离子扫描.扫描范围: ( m/z) 100 ~900 u;正离子模式下质谱参数为: 以氮气作为干燥气和喷雾气,干燥气温度 350 ℃; 氮气流速 11. 0 L/min,雾化气压 35 psi; 离子化方式为 ESI + ,所用的电离电压为 +4 000 V; 毛细管出口电压 106. 0 V; 八级射频电压振幅 171 Vpp; Skim 电压 40. 0 V.色谱分析体系见 1. 2. 4.
1. 2. 3 花青素的定量分析 定量分析采用的HPLC 系统为 Waters 1525 高效液相色谱仪,系统配置包括: Waters 1525 泵、Waters 2998 DAD 检测器、2707 自动进样器.HPLC 所用色谱分析柱为 TSKgel ODS-80 Ts QA ( 150 mm × 4. 6 mm,5 μm i. d. ,Tosoh,Japan) .保护柱为 C18 柱( 10 mm × 4. 6 mm,5 μm,Kromasil,Sweden) .HPLC 所用的流动相组成为: A 相为10%甲酸-水溶液( 含0. 1%TFA) ,B 相为15% 甲醇-乙腈溶液.梯度洗脱程序( B% ) : 0 min,8% ; 20 min,12% ; 30 min,9% ; 55 min,18% ; 70 min,18% ; 71 min,100% ; 81 min,100% ; 83 min,8% ;95 min,8% ; 流速 0. 8 mL / min; 柱温 35 ℃ .检测波长 525 nm.进样体积 30 μL.
1. 2. 4 标准曲线的绘制 以矢车菊素 3-葡萄糖苷( Cyanidin 3-O-glucoside chloride,Cy3G) 为半定量标准物用以建立标准曲线.称取矢车菊素 3-葡萄糖苷标准品适量溶于 1% 盐酸甲醇溶液中,配制成0. 32 mg / mL 的标准储备液.取标准储备液 0. 01,0. 02,0. 05,0. 06,0. 08,1. 00 mL 定容至 10 mL 的1% 盐酸甲醇溶液中,配制成浓度分别为 0. 003 2,0. 006 4,0. 016 0,0. 019 2,0. 025 6,0. 032 0 mg / mL的系列标准溶液,按 1. 2. 3 所述色谱条件进行分析.
利用标准品建立的标准曲线为: Y( 色谱峰面积) =1 419 332 490x( Cy3G 浓度) - 97 335,R = 0. 999 7,表明标准品浓度与吸光度在 0. 003 2 ~0. 032 mg/mL范围内线性关系良好.精密度分析 RSD =0. 5%,显示仪器进样精密度良好.将西伯利亚白刺果实样品中测得花青素成分峰面积带入标准曲线,花青素含量表述为每 100 g 去核鲜果中所含的毫升数,所有样品均测试 3 次.
1. 2. 5 统计分析 试验数据用统计分析软件 SAS9. 0 进行方差分析.
2 结果与分析
2. 1 花青素的鉴定
西伯利亚白刺果实中富含多种黄酮成分,黄酮和花青素在 270 ~ 280 nm 附近均有吸收,而花青素成分在 520 nm 附近波段为特征吸收[10],因此,采用520 nm 附近进行 DAD 扫描,可以有效识别果实提取物中的花青素,避免与黄酮混淆.西伯利亚白刺紫果 525 nm 下提取的色谱图见图 1.
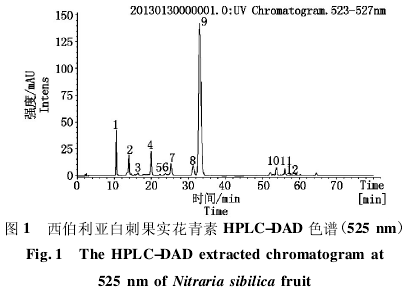
分析色谱峰对应的质谱信号,结合保留时间和二级质谱碎裂模式推测,与已有参考文献进行比对,共识别到 12 个花青素组分,分属 5 种花色素苷元:矢车菊素( Cyanidin,组分 1,2,8,9) 、矮牵牛素( Pe-tunidin,组分 3,5,12) 、芍药素( Peonidin,组分 4,7,11) 、锦葵素 ( Malvidin,组分 6 ) 和天竺葵素 ( Pelar-gonidin,组分 10) ( 表 1) .
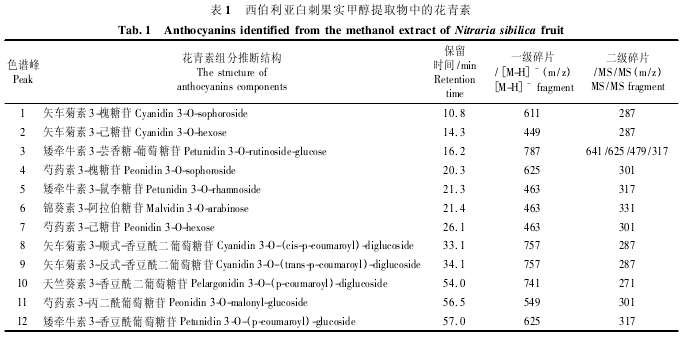
组分 1,[M-H]-= m / z 611; MS / MS = m / z 287,与矢车菊素苷元相符,考虑出峰时间,该物质应为矢车菊素的糖苷衍生物.中性丢失质量 324 Da 为二糖基团.结合参考文献,推测组分 1 为矢车菊素 3-槐糖苷( Cyanidin 3-O-sophoroside)[11].相似的,组分 4( m/z 625/301) 推测为芍药素 3-槐糖苷( Peoni-din 3-O-sophoroside) .
组分 2,[M-H]-= m / z 449; MS / MS = m / z 287,为矢车菊素花青素,中性丢失质量 162 Da,可知含有 1 个已糖基团,常见的已糖配基包括葡萄糖基( -glucoside) 和半乳糖基( -galacoside) ,现有信息无法确定配基,组分 2 推测为矢车菊素 3-己糖苷[12].组分 7( m/z 463/301) 与组分 2 质谱模式相似,鉴定为芍药素 3-己糖苷[12].
组分 3,质 谱 数 据 ( m/z 787/641/625/479/317) ,为矮牵牛素苷元,存在 2 种碎裂方式: 787→641( - 146)→479( -162)→317( -162) ; 787→625( -162)→479( -146)→317( -162) ; 因此,该物质含有2 个已糖基团和1 个戊糖基团,上述特殊的碎裂方式根据已有报道[13]推测组分 3 为矮牵牛素 3-芸香糖-葡萄糖苷( Petunidin 3-O-rutinoside-glucose) .
组分 5,m/z 463/317,中性丢失质量 146 Da,组分 6,m/z 463/331,中性丢失质量 132 Da,分别推测为矮牵牛素 3-鼠李糖苷( Petunidin 3-O-rhamnoside)和锦葵素3-阿拉伯糖苷( Malvidin 3-O-arabinose) ,后者为白刺属植物果实花青素成分中首次报道.
组分 8 与组分 9,[M-H]-= m / z 757,MS / MS =m / z 287,皆为矢车菊素苷元,分子量相同且保留时间接近,推测为一对同分异构体[14].根据丢失质量470 Da = 324 + 146,结合洗脱时间分析,推测该物质含有 2 个已糖和 1 个香豆酸基团[9],二糖基团因被酰基化,MS/MS 条件下易从苷元上完整脱落,获得单一产物离子碎片[15].互为异构的酰基化花青素中,顺式构型的极性强于反式构型,故其保留时间更短[16 -17],因此,组分 8 推断为矢车菊素 3-顺式-香豆酰二 葡 萄 糖 苷 ( Cyanidin 3-O-( cis-p-coumaroyl) -diglucoside) ,组分 9 指认为矢车菊素 3-反式-香豆酰二葡 萄 糖 苷 ( Cyanidin 3-O-( trans-p-coumaroyl) -diglucoside) .
组分 10,MS/MS = m/z 271,为天竺葵素衍生物,组分 12 MS/MS =317,为矮牵牛素衍生物,两组分质谱数据均与组分 8、9 相似,据此可以推断两物质同样含有 2 个已糖基和 1 个香豆酸作为酰化基团[18],因未找到对应异构体,不足以确认顺反构型,故指认为天竺葵素 3-香豆酰二葡萄糖苷( Pelargoni-din 3-O-( p-coumaroyl) -diglucoside) 和矮牵牛素 3-香豆酰 二 葡 萄 糖 苷 ( Petunidin 3-O-( p-coumaroyl) -diglucoside) .
组分 11,[M-H]-= m / z 549,MS / MS = m / z301,丢失质量为 248 Da,根据洗脱顺序和碎裂方式推测为芍药素3-丙二酰葡萄糖苷( Peonidin 3-O-mal-onyl-glucoside)[19],这也是花青素丙二酰基衍生物在白刺属植物果实中的首次报道.
2. 2 花青素含量的测定
通过矢车菊素 3-葡萄糖苷标准品对各样品中花青素进行半定量分析,获得各组分相对含量,结果见表 2.
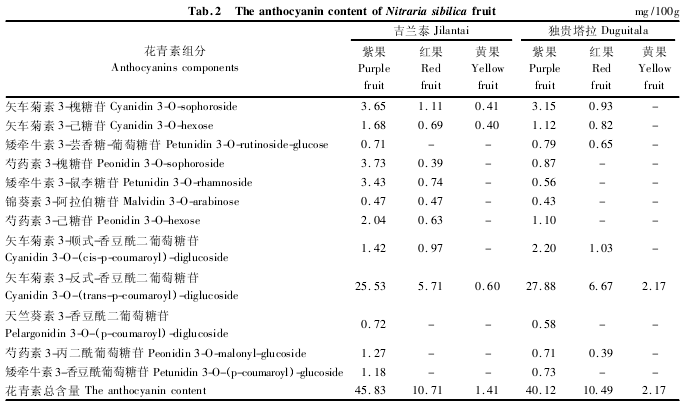
由表 2 可见,每 100 g 吉兰泰、独贵塔拉的西伯利亚白刺紫果样品花青素总含量分别为 45. 83 mg和 40. 12 mg,矢车菊素苷元衍生物在所识别 5 种苷元中数量最多,吉兰泰紫果样品中矢车菊素占花青素总含量的 70. 4%,独贵塔拉样品中占 85. 6%; 芍药素花青素含量比例为 15. 4% ( 吉兰泰) 和 6. 68%( 独贵塔拉) ; 矮牵牛素花青素含量比例为 11. 6%( 吉兰泰) 和 5. 1% ( 独贵塔拉) ; 天竺葵素和锦葵素花青素各有 1 种,含量比例均低于 2%.在花色素母核取代方式上,酰基化形式比单纯糖基取代方式占优势,在所测定的 12 种花青素成分中,酰基化成分有 5 种,含量占花青素总含量的 65. 7% ( 吉兰泰)和 80. 0%( 独贵塔拉) .上述特征最突出的代表是矢车菊素 3-反式-香豆酰二葡萄糖苷( Cyanidin 3-O-( trans-p-coumaroyl) -diglucoside) ,该组分在西伯利亚白刺果实 3 个成熟阶段含量均为最高.随着果实的成熟,果实颜色逐渐加深,花青素含量也显着增高,采自吉兰泰的紫色果实中花青素总量是黄色果实的 30 倍,是红色果实的 3 倍,采自独贵塔拉的紫色果实中花青素含量是黄色果实的 18 倍,是红色果实的近 4 倍.质谱指认的 12 种花青素组分均可在紫色果实中测得,而在红色和黄色果实中花青素组分数目递减.
花青素的大量积累可能与西伯利亚白刺特殊的生境条件有关[20].果实转色到成熟阶段正值夏季,日照强烈,紫外线对果实组织的损伤较重.花青素的积累能够增强果实组织对紫外线胁迫的耐受能力.本研究中西伯利亚白刺果实花青素总含量低于柴达木盆地唐古特白刺,其中矢车菊素 3-反式-香豆酰二葡萄糖苷测得的含量每 100 g 达 215 mg[9],为本研究中含量的近 8 倍,两种白刺属间果实花青素含量的差异可能受物种和分布地域等多方面的影响.本研究通过多因素方差分析对成熟阶段和采集点 2 个因素进行了探讨,结果见表 3. 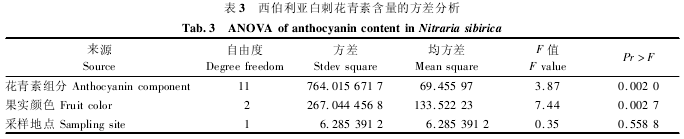
方差分析反映了 2 个地点、3 个成熟阶段对花青素组分含量的影响,结果显示,西伯利亚白刺花青素不同组分间含量有显着性差异( P =0.002 0) ,不同颜色果实的花青素含量有显着性差异( P =0. 002 7) ,而 2 个采样地之间花青素含量无显着性差异( P =0. 558 8) ,这可能是由于采样地处于相近纬度,对花青素合成影响较为明显的光照因素差异有限造成的,对花青素含量和组成的深入分析需要进一步扩大采集的范围,而未来比较同一地点采集的不同种白刺将有助于分析物种间差异对花青素含量的影响.
3 讨论
西伯利亚白刺作为白刺属植物中分布范围较广的一种,在中国东北、西北、华北多个省区市均有分布,具有广泛的适应性[1],在资源植物选育开发和抗逆生物学机理等方面都具有研究价值[21].现有白刺属植物的花青素研究较多针对唐古特白刺,对西伯利亚白刺的重视不够[3].HPLC-ESI-MS/MS 是植物提取物组分识别和结构鉴定的有力工具,本研究通过液质联用手段结合已有报道,定性了内蒙古西部两地点采集的西伯利亚白刺 3 个成熟阶段的果实中 12 种花青素成分,并对各成分进行了半定量分析.结果显示,西伯利亚白刺果实花青素组分包括5 种常见苷元,取代类型丰富,酰化糖基取代占主导,同时存在单糖基取代和多糖基取代,不同组分间含量有显着差异; 在果实成熟的 3 个阶段花青素含量变化明显且受地点的影响不显着.针对西伯利亚白刺广泛分布的特点,在今后的研究中应选取更多采样点对西伯利亚白刺中花青素等活性成分进行分析,从而充分挖掘和实现这一资源植物的经济和生态价值.
参考文献:
[1] 潘晓云,小 平,秋 实,等. 多倍化-白刺属的系统分类、进化特征及应用前景[J]. 植物学通报,2003,20( 5) : 635 -638.
[2] 杨秀艳,张华新,唐 欣,等. 我国白刺植物资源及其开发利用[J]. 世界林业研究,2013,26( 5) : 63 -68.
[3] 潘晓玲,沈观冕,陈 鹏. 白刺属植物的分类学及系统学研究[J]. 云南植物研究,1999,21( 3) : 287 -295.
[4] 王尚德,康向阳. 唐古特白刺研究现状与建议[J]. 植物遗传资源学报,2005,6( 2) : 231 -235.
[5] 赵汝能. 甘肃中草药资源志( 上册) [M]. 兰州: 甘肃科学技术出版社,2004: 723 -725.
[6] 赵晓辉,梅丽娟,邵斌贝,等. 唐古特白刺色素抗氧化活性研究[J]. 安徽农业科学,2009,37( 19) : 89 -92.
[7] 段玉清,谢笔钧. 原花青素在化妆品领域的研究与开发现状[J]. 香料香精化妆品,2002( 6) : 23 -25.
[8] 吕丽爽,曹 栋. 脱脂葡萄籽中低聚原花青素的提取[J]. 无锡轻工大学学报,2002,20( 2) : 208 -210.
[9] Zheng J,Li H,Ding C X,et al. Anthocyanins compositionand antioxidant activity of two major wild Nitraria tangu-torun Bobr. variations from Qinghai-Tibet Plateau[J].Food Research International,2011,44( 7) : 2041 - 2046.
[10] Abad-García B,Berrueta L,Garmón-Lobato S,et al. Ageneral analytical strategy for the characterization ofphenolic compounds in fruit juices by high-performanceliquid chromatography with diode array detection cou-pled to electrospray ionization and triple quadrupolemass spectrometry [J]. Journal of Chromatography,2009,1216( 28) : 5398 - 5415.
[11] Wu X,Prior R L. Systematic identification and character-ization of anthocyanins by HPLC-ESI-MS / MS in com-mon foods in the United States: fruits and berries[J].Journal of Agricultural and Food Chemistry,2005,53( 7) : 2589 -2599.
[12] Latti A K,Riihinen K R,Jaakola L. Phenolic compoundsin berries and flowers of a natural hybrid between bilber-ry and lingonberry ( Vaccinium × intermedium Ruthe )[J]. Phytochemistry,2011,72( 8) : 810 -815.
[13] 刘妮娜,李晓东,张金政,等. 玉簪属植物花瓣中类黄酮化合物价值评价[J]. 草业学报,2013,22( 1) : 234 -244.
[14] Nicoué E,Savard S,Belkacemi K. Anthocyanins in wildblueberries of Quebec: Extraction and identification[J].Journal of Agricultural and Food Chemistry,2007,55( 14) : 5626 -5635.
[15] McDougall G,Fyffe S,Dobson P,et al. Anthocyaninsfrom red cabbage-Stability to simulated gastrointestinaldigestion[J]. Phytochemistry,2007,68 ( 9 ) : 1285 -1294.
[16] Downey M,Rochfort S. Simultaneous separation by re-versed-phase high performance liquid chromatographyand mass spectral identification of anthocyanins and fla-vonols in Shiraz grape skin[J]. Journal of Chromatogra-phy,2008,1201( 1) : 43 - 47.
[17] George F,Figueiredo P,Toki K,et al. Influence of trans-cis isomerisation of coumaric acid substituents on colourvariance and stabilisation in anthocyanins[J]. Phyto-chemistry,2001,57( 5) : 791 - 795.
[18] Eichhorn S,Winterhalter P. Anthocyanins from pigmen-ted potato ( Solanum tuberosum L. ) varieties[J]. FoodResearch International,2005,38: 943 - 948.
[19] Donner H,Gao L,Mazza G. Separation and characteriza-tion of simple and malonylated anthocyanins in red on-ions,Allium cepa L. [J]. Food Research International,1997,30( 8) : 637 - 643.
[20] 王文星,安 琪,汪 莹,等. 瑞香狼毒细胞悬浮培养及黄酮积累的研究[J]. 草业学报,2010,19( 6) : 132 -139.
[21] 郑琳琳,张慧荣,贺龙梅,等. 唐古特白刺质膜 Na+/H+逆向转运蛋白基因的克隆与表达分析[J]. 草业学报,2013,22( 4) : 179 -186.





