奥林达夏橙CsTBL1启动因子克隆及其表达
时间:2014-06-28 来源:未知 作者:傻傻地鱼 本文字数:4065字
启动子是调控基因表达过程中重要的转录调节因子,分析启动子时空表达模式可以精确可靠地定位基因的表达部位,对研究基因的时空表达模式和验证基因功能具有重要意义(Ayoubi & van DeVen,1996;聂丽娜 等,2008)。DUF231 家族是一类植物特有但功能未知的蛋白,这类蛋白的主要特点是包含保守的 DUF231结构域(Bouchabke-Coussa et al.,2008;Synthase,2010;Gille et al.,2011)。拟南芥中包含 46 个DUF231 家族成员,只有 3 个成员(ESK1、AXY4/AXY4L 和 TBR/TBL3)被克隆鉴定,其功能主要涉及植物抗逆反应以及植物发育阶段细胞壁的次生代谢(Xin,1998;Xin et al.,2007;Lugan et al.,2009;Bischoff et al.,2010)。鉴于 DUF231 家族基因功能的重要性,研究其表达的调控机制具有重要意义。已报道的 DUF231 家族基因表达多具有组织特异性和时空表达模式,如 ESK1 基因主要在次生壁形成的细胞、木质部和维管束纤维上表达(Yuan et al.,2013);TBR 基因启动子驱动 GUS 报告基因在 9 d 龄拟南芥幼苗根和叶片毛状体中高表达,在 3 ~ 4 周龄植株中却只在叶片维管束和快速生长的根尖上表达,而 6 周后基本不表达(Bischoff et al.,2010)。目前对 DUF231 家族基因功能的了解只局限于模式植物拟南芥,在其它物种中还未见报道。
在本实验室前期工作中首次从木本植物奥林达夏橙中克隆到 1 个受乙烯强烈诱导的 DUF231 家族基因 CsTBL1(登录号:KJ094573),该基因与拟南芥 TBR 有 57%相似度,但是其功能和表达模式尚不清楚(张凌云,2010)。本研究中利用甜橙基因组信息,从奥林达夏橙中克隆到 CsTBL1 的启动子,利用生物信息学手段分析了启动子的顺式作用元件,用该启动子与 GUS 基因融合的植物表达载体转化拟南芥,并研究该启动子时空表达模式及对外源植物激素的响应,为初步了解 CsTBL1 在植物发育过程中的表达模式提供试验依据。
1、 材料与方法
1.1 试验材料
试验于2012—2013年在中国农业科学院柑桔研究所资源室进行。奥林达夏橙[Citrus sinensi(sL.)‘Olinda’]叶片采自中国农业科学院柑桔研究所资源圃。pEASY-T1Vector 购自北京全式金生物技术有限公司,大肠杆菌 DH5α、农杆菌 LBA4404、表达载体 pBI121 由本实验室保存。
用于转化的哥伦比亚(Columbia,Co1)野生型拟南芥在 22 ℃,16 h 黑暗/8 h 光照条件下营养生长 4 周,然后在 22 ℃,8 h 黑暗/16 h 光照条件下生殖生长至盛花期。
1.2 DNA 和 RNA 的提取与 cDNA 的合成
柑橘叶片和拟南芥植株的 DNA 小量提取参照天根公司 Plant Genomic DNAKit 说明书操作。使用 QIANGEN 公司 DNeasy Plant Maxi Kit 提取转基因拟南芥基因组 DNA 用于 Southern 杂交,提取过程按操作说明书进行。使用天根公司 RNAprep pure Kit 试剂盒提取拟南芥植株总 RNA。使用TaKaRa 公司 PrimeScriptTMRT reagent Kit 反转录试剂盒合成 cDNA。
1.3 启动子序列克隆、分析和载体构建
用 CsTBL1 cDNA 全长与甜橙基因组序列进行 Blastn 比对获得 CsTBL1 上游启动子参考序列。利用参考序列设计引物(P1/P2,表 1),以奥林达夏橙基因组DNA 为模板,经 PCR 扩增获得的产物连接到 pEASY-T1载体上,交北京华大公司测序。测序返还序列与参考序列利用 DNAStar 软件进行比对分析,利用 PLACE 数据库分析该启动子序列的调控元件(Lescot et al.,2002)。测序正确的转化子利用 Hind Ⅲ和 BamHⅠ双酶切替换 35S 启动子,连接到含有 GUS 基因的 pBI121 载体上,重组质粒pCsTBL1-GUS(图 1)。经过酶切和测序(测序用载体引物 PF/PR,表 1)检测正确的重组质粒利用冻融法转入农杆菌 LBA4404。
1.4 CsTBL1 基因启动子转化拟南芥
根据农杆菌介导的浸花法用重组质粒 pCsTBL1-GUS 转化拟南芥(Zhang et al.,2006)。将获得的 T1拟南芥种子消毒后播种在含有 50 mg · L-1Kan(卡那霉素)的 MS 培养基中培养,初步挑选出绿色抗性苗,并移栽到营养土中。提取 T1代抗性苗的 DNA,用 Kan 抗性位点序列设计引物 NPTⅡ(NPTⅡF/NPTⅡR,产物大小是 589 bp,表 1)检测转基因植株。以 NPTⅡ引物 PCR 扩增产物制作探针,对 T3代转基因拟南芥拷贝数进行 Southern 杂交鉴定。
具体方法参照 Roche 公司生产的“DIG High Primer DNALabeling and Detection Starter KitⅠ”试剂盒说明书进行。
1.5 GUS 组织化学染色
参照 Ni 等(2008)的 GUS 组织化学染色法配置染液。取不同生长时间段的拟南芥组织放入 GUS染液中 37 ℃过夜,用 75%的酒精脱色至完全,然后在显微镜下观察拍照。
1.6 外源激素处理下转基因拟南芥 GUS 基因的表达分析
对生长20 d的T3代转基因拟南芥用100 mol · L-1ABA,20 mol · L-1ACC,200 mol · L-1MeJA,20 mol · L-1SA 处理 12 h 后,收集样品–80 ℃保存。使用 qRT-PCR 分析 GUS 基因的表达量。GUS(GUS-F/GUS-R)引物和拟南芥内参引物 Tubulin(Tubulin-F 和 Tubulin-R)(Oate-Sánchez et al.,2007)见表 1。定量实时 PCR 使用 Promega GoTaqqPCR Master Mix,在 Bio-Rad CFX96TM荧光定量 PCR 仪(Bio-RAD,USA)上进行。PCR 反应体系(20 L)包含 10 L Master Mix(2×)、0.2 L正向引物(10 mol · L-1)、0.2 L 反向引物(10 mol · L-1)、总 cDNA1 L。PCR 反应程序为 95 ℃变性 2 min 后按如下参数循环 40 次:95 ℃ 10 s、60 ℃ 60 s,设置溶解曲线,以检测引物是否可用。设置 3 次生物学重复和 3 个计数重复。数据分析按照公式(2-Ct,Ct = Ct目标基因–Ct内参基因)计算。设定未处理材料的数据(对照)为 1,其他数据相对进行比较。使用 Spass19.0 软件进行数据显著性分析。
2、 结果与分析
2.1 序列克隆、分析和表达载体的构建
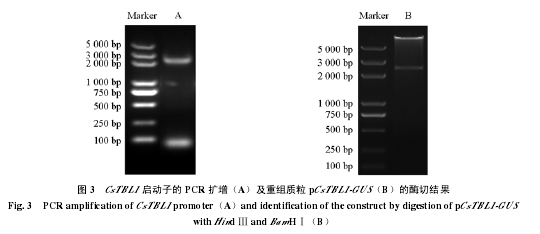
以 CsTBL1 cDNA 全长序列与甜橙基因组序列进行 Blastn比对,获得了 CsTBL1 的基因上游启动子参考序列,并据此设计了引物,从奥林达夏橙的基因组 DNA中克隆到该基因的启动子。测序结果表明获得的启动子长为 2 361 bp(图 2),与参考序列的相似度达到 98%。用在线网站 PLACE 数据库分析CsTBL1 基因启动子序列,结果见表 2,可见该启动子含有与逆境和植物激素应答相关的顺式作用元件 ABRE、ASF、GARE、GT1 和 MYB 等。


该启动子经双酶切从TA克隆中卸载,并且经分子操作成功替换了pB1121载体上的35S启动子,如图 3 所示,所获得的 pCsTBL1-GUS 表达载体经过测序和双酶切,证实构建正确。
2.2 转基因拟南芥的获得及验证
通过 Kan 抗性筛选,共获得 8 株抗性转化植株。用 NPTⅡ引物检测所获得的 T1代转基因植株,发现所有抗性植株均呈转基因阳性(图 4),说明抗性筛选有效。有 6 个 T2代转基因株系的抗性与非抗性苗比例为 3︰1,初步认为是单拷贝插入。对转基因株系后代 T3进行 Southern 杂交验证(图 5),验证结果是 2、3、5、6、7 和 8 号株系确实为单拷贝 T-DNA 插入。
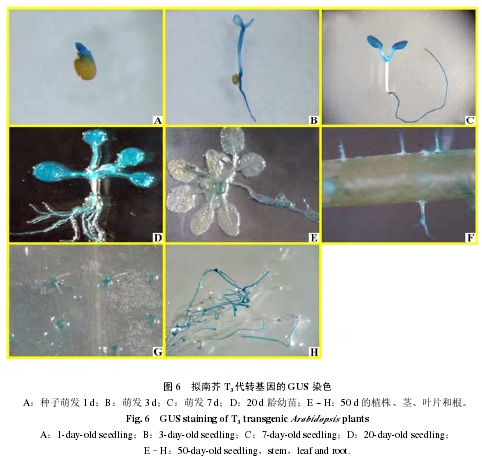
2.3 不同时期转 CsTBL1 拟南芥植株的 GUS 组织化学染色
选取萌发 1、3、7、20 和 50 d 的 T3代单拷贝插入转基因株系进行 GUS 染色。结果表明,种子刚刚萌发 1 和 3 d 时 GUS 表达量最高(图 6,A、B)。萌发 7 和 20 d 的幼苗的子叶、真叶和根中GUS 活性也很强(图 6,C、D)。在幼苗生长 50 d 后,转基因拟南芥中 GUS 活性下降,只在叶片和茎的毛状体以及生长的根中有表达(图 6,E ~ H)。说明 CsTBL1 在拟南芥中的表达存在时空差异,主要在生长初期以及正在发育的组织中表达。
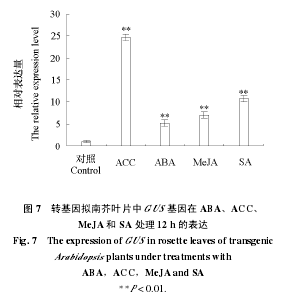
2.4 转 CsTBL1 启动子拟南芥中 GUS 基因在 ABA、ACC、MeJA 和 SA 处理下的表达用不同植物激素对生长20 d的转基因拟南芥幼苗处理 12 h,检测其叶片中 GUS 的转录水平。结果(图 7)显示,乙烯合成前体 ACC(1–氨基环丙烷–1–羧酸)可以强烈诱导GUS 的表达,这与之前期芯片数据显示的CsTBL1 基因受乙烯强烈诱导的结果(张凌云,2010)相一致。外源 ABA(脱落酸),MeJA(甲基茉莉酸)和 SA(水杨酸)也均可诱导 GUS基因的表达。
3、讨论
现已报道的启动子主要分为 3 大类:组成型、诱导型和组织特异型(Carninci et al.,2006;Li et al.,2006)。组织特异型启动子是启动子中一种重要的类型,其结构类型比较复杂,这类启动子控制目的基因在特定组织和器官表达,所被调控基因往往表现出与特定的代谢活动或发育时期相关的特点(宋扬 等,2007;梅丽,2008;颜彦,2013)。本研究显示,CsTBL1 启动子驱动 GUS 报告基因在 1 ~ 3 d 龄的整株幼苗与 7 ~ 20 d 龄幼苗的叶片和根中强烈表达,随着植株的发育 GUS 活性降低,50 d 龄幼苗中只在叶片和茎的毛状体以及根尖中检测到 GUS 活性。这与其拟南芥同源基因 TBR 启动子的表达模式相似,报告基因在幼苗的叶片和茎的毛状体中大量表达,而成年植株中只在快速生长部位表达(Bischoff et al.,2010)。这说明 CsTBL1 表达具有时空和组织特异性,与植物早期发育密切相关。
组织特异性启动子不仅具有一般启动子的结构,在其上游区域还含有控制特异组织表达的调控位点(Guilfoyle,1997;梅丽,2008)。根据已报道的启动子分析,组织特异性启动子的顺式作用元件多成保守性,如 GTGA 和 TGTGG 序列是花特异性表达元件(郭盈盈 等,2013),B-box 元件在种子特异启动子中高度保守(Ezcurra et al.,1999)。CsTBL1 基因启动子顺式元件分析,它含有多拷贝与毛状体特异表达相关的顺式作用元件 MYB(Wang et al.,2002;Ni et al.,2008;Shangguan et al.,2008)。在柑橘的幼叶、幼梢、幼果甚至成熟果实上也有纤毛,纤毛的发育是否也有 CsTBL1 的参与尚需进一步的研究。
CsTBL1 启动子生物信息学分析显示其含有诸多逆境应答作用相关元件,如 ASF、ABRE、GT1MYC 和 GARE 等,推测该启动子可能响应多个调控因子。茉莉酸/乙烯途径和水杨酸依赖途径是植物两大重要的防卫应答信号途径(Pieterse et al.,2001;Horváth et al.,2007;Loake & Grant,2007)。而本试验中外源 ACC、MeJA 和 SA 的处理均可显著提升 GUS 的表达量,证实了上述推论的正确性,同时也说明了 CsTBL1 可能受这两种防卫信号途径交叉调节。值得注意的是,前期研究及本试验均证明 CsTBL1 受乙烯强烈诱导,是乙烯信号途径中的下游基因,但是 CsTBL1 启动子生物信息预测却没有发现乙烯相关的调控元件,此结果暗示了 CsTBL1 启动子中存在受乙烯调控的未知元件,有待于进一步挖掘。
- 相关内容推荐





