长期运动可诱导机体运动性心肌肥大,这种肥大反应一般归为生理性肥大的范畴;然而,不适当或过度运动也可致心脏损害。心肌肥大主要以心肌细胞体积增大为主,蛋白质合成增多,许多研究已阐明,哺乳动物雷帕霉素靶蛋白(mTOR)在调控生理性肥大中发挥着重要的作用[1-3],集中体现在其下游信号分子p70核蛋白体S6激酶(p70S6K)和真核翻译起始因子4E结合蛋白(4EBP1)上,被mTOR激活的p70S6K通过磷酸化rpS6促进mRNA的5'帽子结构(5'TOPmR-NA)的翻译和增加与翻译有关的底物(如eIF4B和eEF2激酶)的接触来控制细胞生长[4-6];mTOR还可以磷酸化4EBP1使之释放eIF4B,eIF4B与eIF4A和eIF4G组成的复合物eIF4F是最重要的翻译起始因子之一[7],它与核糖体43S相互作用,识别5'TOPmRNA从而使核糖体开始扫描翻译[8-9].
因此本实验研究长期不同强度对心肌中4EBP1和p70S6K蛋白表达及其磷酸化的影响,试探讨由运动诱导的风险不同的心肌肥大是否具有相同的分子机制。
1、材料与方法
1.1实验对象
7周龄SPF级雄性SD大鼠,体重(237.84±83.37)g,购自北京维通利华实验动物技术有限公司,国家标准啮齿类动物生长饲料喂养,自由饮食饮水。饲养温度22~24℃,相对湿度30%~60%.随机分为9组,每组6只:安静组C、中等强度组(运动后即刻取材组M0、6h取材组M1、12h取材组M2和24h取材组M3)、大强度组(运动后即刻取材组H0、6h取材组H1、12h取材组H2和24h取材组H3).组间体重无显著性差异(P>0.05).
1.2运动模型
中等强度组和大强度组大鼠首先进行4d适应性训练,休息2d后再进入正式训练(参考Bedford递增负荷跑台训练).训练开始时,均以15m/min,15min的运动负荷训练,每隔2d速度增加5m/min,时间增加5min,中等强度至强度达28m/min,60min,大强度至强度达38m/min,60min;训练7周,每周训练5d,休息2d.
1.3取材
末次运动后各组动物按时间点分别在取材前快速称量体重。以5mL/kg,20%乌拉坦腹腔麻醉,腹主动脉取血后,剪开胸部两侧皮肤和胸骨,去除心包膜后,迅速取出心脏,用生理盐水冲洗,滤纸吸干称重。将左心室室心尖处肌肉切成每块重约100mg大小分装,于-70℃保存,留作匀浆用。
1.4总蛋白含量的测定
采用BCA测试方法,按照试剂盒说明操作。取1mg/mLBSA标准蛋白分别配制0、0.05、0.1、0.2、0.4、0.6、0.8和1mg/mL浓度梯度,再用PBS补足到50μL以制备标准曲线。BCA工作液配制按50∶1的比例,将BCA试剂A和BCA试剂B混匀,配制得到BCA工作液待用。将标准品加入微孔板内,以同样的方法将处理过的样本也加入微孔,各孔200μLBCA工作液,室温静置2h.颜色会随着时间的延长而发生深浅不一的变化,以此测定蛋白浓度。根据蛋白浓度的标准曲线,对应算出所测样本的蛋白总浓度。
1.5Westernblot测定蛋白含量
取心肌100mg,加入液氮后磨成粉末并移入已预冷的1mL蛋白裂解液的EP管中,摇匀后低温静置20min,于4℃,12000r/min离心15min取上清液分装待测。根据总蛋白含量,按16μL上样量通过SDS-PAGE电泳将蛋白转至NC膜上,封闭1.5h后一抗孵育4℃过夜(不同抗体稀释比例:GAPDH为1∶1000,p-p70S6K(Thr389)和p-70S6K为1∶500,p-4EBP1(Thr37/46)和4EBP1为1∶1000),第2天TBST漂洗后室温振荡二抗(一般稀释比例为1∶10000)孵育60min(抗体均购自CellSig-naling公司).TBST漂洗后使用ECL发光显影,胶片曝光,放入Bio-Rad凝胶成像仪中进行拍摄得到目的条带图像。用QuantityOne软件进行图像分析,得出目的条带的光密度值。将每一个目的条带与相应的内参条带GAPDH的光密度值进行比较,以安静对照组的蛋白的相对含量为1,实验组目的蛋白相对含量与对照组目的蛋白的相对含量进行比较,计算得出与对照组的比值。
1.6统计学分析
实验数据以均数±标准差(M±SD)表示,组间比较采用单因素方差分析。显著性检验水平以P<0.05表示差异具有显著性差异,P<0.01表示具有非常显著性差异。数据处理采用SPSS16.0统计软件进行分析。
2、结果
2.1心系数
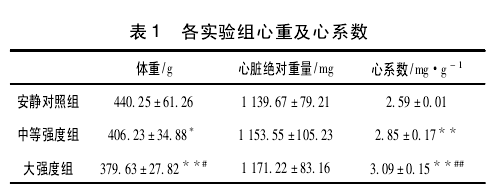
心脏重量反映了心肌肥大的程度,通常用心脏的相对重量即心系数(心脏绝对重量与体重的比值)作为判断心脏肥大的指标。如表1所示,各组的心脏绝对重量无显著差异(P>0.05);中等强度组体重与安静组对比有显著性差异(P<0.05),大强度组体重与安静组对比有非常显著性差异(P<0.01),而大强度和中等强度比较亦有显著性差异(P<0.05);中等强度和大强度的心系数与对照组相比及中等强度和大强度相比均有非常显著性差异(P<0.01).
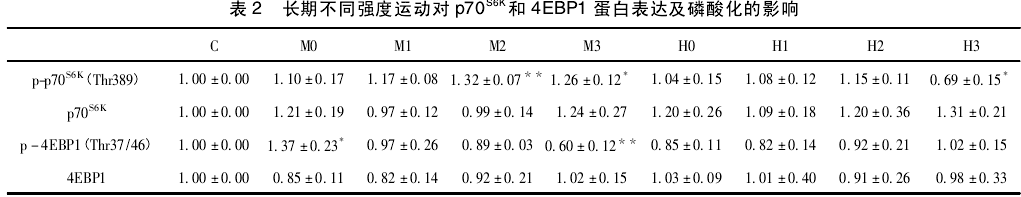
2. 2 、不同运动强度对 p70S6K蛋白及其磷酸化表达的影响如表2、图1(A)所示,中等强度运动后即刻磷酸化p70S6K(Thr389)与对照组相比,在运动后即刻和6h无显著差异(P>0.05),在12h达到峰值且有非常显著差异(P<0.01),运动后24h仍有显著差异(P<0.05),并未恢复至安静水平;而大强度各时刻与对照组相比,均未见显著性差异(P>0.05),但呈现升高的趋势,而在运动后24h明显降低(P<0.05).如图1(B)所示,中等强度组和大强度组p70S6K蛋白各时刻与对照组相比均无显著差异(P>0.05).
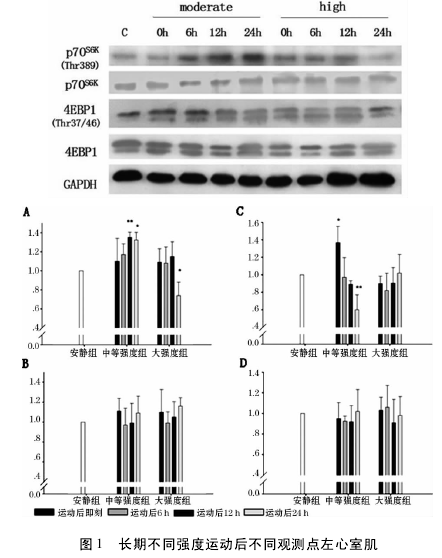
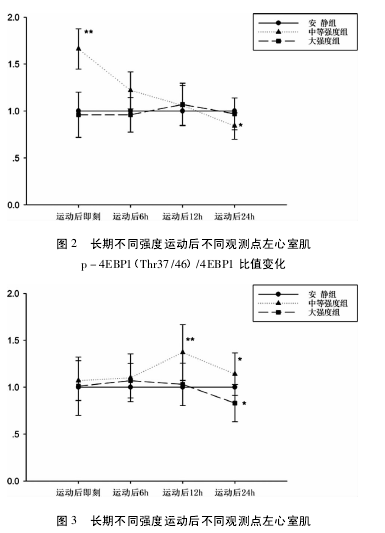
2. 3 、不同运动强度对 4EBP1 蛋白及其磷酸化表达的影响 如图 1( C) 所示,中等强度组磷酸化 4EBP1( Thr37/46) 在运动后即刻出现峰值,与对照组相比有显著性差异( P < 0. 05) ,随后呈现下降趋势,在末次运动后 24 h 出现最低值,与对照组比具有非常显著性差异( P <0. 01) ; 大强度组与对照组比均未见显著性差异( P >0. 05) ,也未见明显趋势。如图 1( D) 所示,中等强度组和大强度组 4EBP1 蛋白各时刻与对照组相比均无显著性差异( P >0. 05) .影响 如表 2、图 1( A) 所示,中等强度运动后即刻磷酸化 p70S6K( Thr389) 与对照组相比,在运动后即刻和6h 无显著差异( P > 0. 05) ,在 12 h 达到峰值且有非常显著差异( P <0. 01) ,运动后 24 h 仍有显著差异( P< 0. 05) ,并未恢复至安静水平; 而大强度各时刻与对照组相比,均未见显著性差异( P > 0. 05) ,但呈现升高的趋势,而在运动后24 h 明显降低( P <0. 05) 。如图 1( B) 所示,中等强度组和大强度组 p70S6K蛋白各时刻与对照组相比均无显著差异( P >0. 05) 。2. 4 不同运动强度对 p-4EBP1( Thr37 /46) /4EBP1比值的影响 结果如图2 所示,中等强度组 p -4EBP1( Thr37/46) /4EBP1 比值运动后即刻达到峰值,在运动后 24 h 内逐渐降低; 而大强度组无明显的趋势。2. 5 不同运动强度对 p-p70S6K( Thr389) /p70S6K比值的影响 结果如图 3 所示,中等强度组 p-p70S6K( Thr389) /p70S6K比值在运动后有逐渐升高的趋势,在12h 达到峰值,24 h 内未恢复至安静水平; 而大强度组从运动后6 h 开始出现下降趋势,至24 h 出现最低值。
3 、讨 论
运动一般被认为是一种对心脏的良性刺激,长期运动会引起心脏形态和功能的适应性变化,这不仅有助于提高运动成绩、增强体质,还可作为一些心血管疾病的治疗手段; 然而,在运动员及体育锻炼人群中,与心脏有关的负面影响也引起了我们的重视。不论何种心肌肥大刺激因素( 如高血压、运动、妊娠等) ,持续的肥大反应与猝死或心衰的危险性成正比[10 -12],运动性心肌肥大与猝死密切相关,其中心源性猝死占运动猝死的 80%[13 -15].本实验中,长期 2 种强度运动均引起了大鼠心肌肥大,且大强度所诱导的肥大反应更加显著,李奕等报道长期大强度运动后心肌缺血缺氧严重,心肌细胞有明显损伤,与中等强度组和对照组形态差异显著[16].为探究同样性质的刺激( 运动)所诱导的心肌肥大是否具有相同的分子机制,我们测定了现认为在生理性肥大中发挥重要作用的 mTOR下游信号蛋白 p70S6K和 4EBP1.
3. 1 、长时间不同强度运动后心肌 p70S6K的作用 核糖体蛋白 S6 上的多个位点可被 p70S6K磷酸化,激活的核糖体蛋白 S6 由于位于 40S 核糖体 tRNA-mRNA 的特殊位点而选择性地使含 5'TOPmRNA 的 mRNA 翻译效率和血清刺激性蛋白合成增加[17 -19].无论是在离体或在体的心肌肥大模型中还是新生大鼠心肌发育过程中,p70S6K在调节蛋白质合成中发挥了重要的作用[20 -22]; 在长期单纯运动的干预下如游泳和跑台训练及结合药物或其它因素的实验研究中,均显示 p70S6K的激活水平与心肌肥大及一些病理变化的转归成正相关[1,23 -25]; 而当 p70S6K敲除后的心肌依然表现出肥大反应,说明 p70S6K非常重要但并不是唯一控制肥大反应的信号[26].
本研究中,运动组各组 p70S6K蛋白表达均与安静组相 比 无 显 著 差 异,中 等 强 度 组 磷 酸 化 p70S6K( Thr389) 水平在运动后 12 h 显著高于安静组,说明p70S6K在中等强度组大鼠心肌中被明显激活,这与大部分的研究结果一致,且此激活时间点也比相关报道中 p70S6K上游 mTOR 的激活时间延后[16,27].而本实验中,长期大强度运动后,心肌肥大并没有伴随 p70S6K的激活,至少在 7 周运动末期未见其表达显著增加,甚至在运动后的 24 h 出现显著降低的情况,提示大强度运动可能并不通过该信号蛋白的激活来诱导心肌肥大,或在本实验所观察的 7 周运动后期未见发挥作用。目前,报道有关单纯大强度所诱导心肌肥大中p70S6K作用的研究甚少,但有报道长期大强度间歇运动后上游 mTOR 及 p70S6K却有显著表达[28],由于一般mTOR 与 p70S6K的激活一致,这似乎与本研究结果相左,但考虑到机体对于不同的运动强度和方式及各种运动的组合和交叉作用的反应差异很大,且大强度的刺激可能通过其它通路的信号分子或通过该通路的其它信号抑制 p70S6K的活性等进而调控心肌肥大反应,更确切的结论需要反复的实验及更全面地测定相关信号通路的蛋白表达来进行证实。
3. 2 、长时间不同强度运动后心肌 4EBP1 的作用4EBP1 即真核细胞翻译起始因子 4E( eIF4E) 的结合蛋白,去磷酸化的 4EBP1 可以结合 eIF4E 从而阻止其与eIF4G 结成生成 eIF4F,而 eIF4F 与 mRNA 的帽子结构识别后才能启动蛋白质的翻译过程[8 -9].磷酸化的4EBP1 可以将 eIF4E 释放出来从而促进蛋白质合成。
在本实验中,各运动组 4EBP1 蛋白含量在各取材点与安静组相比均不具有显著差异,也未见明显的变化趋势; 而磷酸化 4EBP1( Thr37/46) 在中等强度组运动后即刻达到峰值,显著高于安静水平,随着时间逐渐降低,从运动后 6 h 开始低于安静水平,24 h 之后非常显著地低于安静时的磷酸化表达量。我们发现4EBP1 的激活和时程变化与 p70S6K的变化趋势及心肌内蛋白质合成的增加有所出入。以往研究中,长期运动的干预后 4EBP1 磷酸水平均显示上调且一般与p70S6K激活一致[1,23,25].
磷酸化4EBP1( Thr37/46) 峰值在运动后即刻就出现且早于磷酸化 p70S6K( Thr389) 可能是由于运动诱导使 p70S6K磷酸化持续时间较 4EBP1 长,因为 p70S6K的完全激活需要更多其它信号刺激输入。对于在运动后 24 h 内磷酸化 4EBP1( Thr37/46) 表达量低于安静水平,可能与其上游其它一些可以作用于 4EBP1 的信号蛋白有关。如在一些骨骼肌相关的信号转导研究中也出现过磷酸化的4EBP1( Thr37/46) 的变化与磷酸化的 p70S6K( Thr389) 甚至其上游信号蛋白 mTOR 变化相反的情况[29 -30],当然在不同的组织中信号间的相互作用存在很大差异,但由于目前在心肌这一方面研究并不多,骨骼肌中相关信号相互作用也许有借鉴作用。这些研究表明,调控 4EBP1 的上游信号比我们以往想象的更为复杂[31],如在骨骼肌中 4EBP1( Thr37/46) 对雷帕霉素作用于 mTOR 并不敏感,4EBP1 可能由其它机制调控如上游的 TSC2,这些猜想是否适用于心肌,可以通过测试其上游信号 mTOR 分子活性或在实验中加入 mTOR 阻断剂来实现。另外,在运动后 4个时间观测点磷酸化的4EBP1( Thr37/46) 下调且与磷酸化的 p70S6K( Thr389) 变化趋势不一致也并不能否定它在中等强度运动后心肌发生肥大过程中蛋白质合成的作用,因为在 24 h 内的变化可能部分反映的是最后一次运动对该分子的影响,24 h 后的变化情况我们不得而知,由于心肌的肥大反应是一个长期作用的过程,就本实验结果来说更长时间范围的观察显得十分必要,如有一些同样研究长时间运动对心肌一些蛋白表达的实验中,为避免急性运动后对目的蛋白表达量的影响,设计最后一次运动后的 24 ~48 h 再进行取材并指标测试[1].
而在大强度组中,运动后 4EBP1 也未见激活,与p70S6K的测试结果一致,提示长期大强度训练后心肌的肥大似乎并不通过 p70S6K和 4EBP1 进行调控,至少与长期中等强度后心肌肥大的分子机制不尽相同,但我们并不能否定 2 信号在大强度诱导心肌肥大发生的初期的可能作用; 如果在以后实验中对大强度肥大模型的大鼠进行 2 信号的阻断,或对大强度运动干预早期也进行部分指标的测定,或许可能对以上问题进行解答。另外,心肌肥大主要是以心肌细胞体积增大为主,本质是蛋白质合成增多,在这个过程中蛋白质合成同样伴随着分解,要全面的分析与回答有关心肌肥大中信号传导的一些疑问的需要更多的实验研究来实现。
目前研究已证实,心脏不同性质的肥大反应是由不同的信号通路进行调控的,但不同性质的刺激是否就决定了肥大的最终性质,如运动诱导的心肌肥大是否一定属于生理范畴,高血压等病理因素在引起心肌肥大的早期是否就是病理性的; 另外,在心肌肥大的发生和发展过程中,是否刺激因素就决定了特定信号途径的激活和抑制,我们认为这些有待更多的实验研究来解答。毕竟肥大反应是一种长期的适应过程,更多时间点选取的研究设计显得非常重要。
4 、结 论
本实验研究中,长期中等强度和大强度的运动均引起了大鼠心肌肥大,其中 p70S6K、4EBP1 信号分子在中等强度组心肌肥大中发挥了作用,而在大强度组中未见激活。因而推测长期大强度运动所诱导的心肌肥大的分子机制与中等强度不尽相同,本研究的信号蛋白可能在大强度中受到其它通路( 如 Calcineurin/NFATs 通路)的抑制,或由其它通路调控肥大反应。大强度运动所引起肥大的性质及其与相关信号蛋白的关系需要功能检查、组织检查及血液指标进一步论证。
参考文献:
[1]Kemi O. J. ,Ceci M. ,Wisloff U. ,et al. Activation or in-activation of cardiac Akt / mTOR signaling diverges physio-logical from pathological hypertrophy[J]. J Cell Physiol,2008,214( 2) : 316 - 321.
[2]Song X. ,Kusakari Y. ,Xiao C. Y. ,et al. mTOR attenu-ates the inflammatory response in cardiomyocytes and pre-vents cardiac dysfunction in pathological hypertrophy[J]. Am J Physiol Cell Physiol,2010,299 ( 6) : C1256- 1266.
[3] McMullen J. R. ,Sherwood M. C. ,Tarnavski O. ,etal. Inhibition of mTOR signaling with rapamycin regressesestablished cardiac hypertrophy induced by pressure over-load[J]. Circulation,2004,109( 24) : 3050 - 3055.
[4] Jefferies H. B. , Fumagalli S. , Dennis P. B. , etal. Rapamycin suppresses 5'TOP mRNA translationthrough inhibition of p70 s6k[J]. EMBO J,1997,16( 12) : 3693 -3704.
[5]Schwab M. S. ,Kim S. H. ,Terada N. ,et al. p70( S6K)con-trols selective mRNA translation during oocyte maturationand early embryogenesis in Xenopus laevis[J]. Mol CellBiol,1999,19( 4) : 2485 - 2494.
[6]Browne G. J. ,Finn S. G. ,Proud C. G. Stimulation of theAMP-activated protein kinase leads to activation of eukary-otic elongation factor 2 kinase and to its phosphorylation ata novel site,serine 398[J]. J Biol Chem,2004,279( 13) : 12220 -12231.
[7] Gingras A. C. ,Raught B. ,Sonenberg N. eIF4 initiationfactors: effectors of mRNA recruitment to ribosomes andregulators of translation[J]. Annu Rev Biochem,1999,68: 913 - 963.
[8] Hentze M. W. eIF4G: a multipurpose ribosome adapter?[J]. Science,1997,275( 5299) : 500 -501.
[9]Wang X. ,Proud C. G. The mTOR pathway in the controlof protein synthesis[J]. Physiology( Bethesda) ,2006,21: 362 - 369.
[10]Kannel W. B. ,Gordon T. ,Offutt D. Left ventricular hy-pertrophy by electrocardiogram. Prevalence, incidence,and mortality in the Framingham study[J]. Ann InternMed,1969,71( 1) : 89 - 105.
[11]Levy D. ,Garrison R. J. ,Savage D. D. ,et al. Prognosticimplications of echocardiographically determined left ven-tricular mass in the Framingham Heart Study[J]. N EnglJ Med,1990,322( 22) : 1561 - 1566.
[12]Vakili B. A. ,Okin P. M. ,Devereux R. B. Prognostic im-plications of left ventricular hypertrophy[J]. Am Heart J,2001,141( 3) : 334 - 341.
[13]Maron B. J. Pelliccia A. The heart of trained athletes: car-diac remodeling and the risks of sports,including suddendeath[J]. Circulation,2006,114( 15) : 1633 - 1644.
[14]Maron B. J. Hypertrophic cardiomyopathy and other causesof sudden cardiac death in young competitive athletes.