摘 要: 蛋白酶体是细胞内存在的一种多亚基复合物,对真核细胞内环境的稳态有着至关重要的作用.其中,免疫蛋白酶体是能够调控炎症因子、参与MHCGI抗原提呈路径的一类特殊蛋白酶体.本文对近年来免疫蛋白酶体在病毒复制、免疫逃逸、致病性以及抗病毒治疗等方面的研究进展进行综述,为设计新型抗病毒药物提供新思路.
关键词: 蛋白酶体; 免疫蛋白酶体; 病毒复制; 免疫逃逸; 抗病毒治疗;
Abstract: Proteasome is a multi-subunit complex existing in cells and plays a vital role in the homeostasis of eukaryotic cells.While immunoproteasomes are a class of proteasomes that can regulate the production of inflammatory cytokines, participate in the MHC-I antigen presentation pathway.This article mainly reviewed the recent research progress of immunoproteasomes in viral replication,immunity escape,pathogenicity and antiviral therapy.Which will be helpful for praiding new insight for the design of new antiviral drug.
Keyword: proteasome; immunoproteasome; viral replication; immunity escape; antiviral therapy;
在真核细胞中,蛋白酶体的功能包括降解细胞质和细胞核内受损的、错误折叠或展开的蛋白质,参与调控蛋白质的运输、转录和信号转导相关蛋白质的表达水平,从而控制细胞内蛋白质的质量,维持细胞内环境的稳态[1].免疫蛋白酶体(immunoproG teasome,IP)是其中一种特殊的蛋白酶体,除了上述基本功能外,还能够调控细胞凋亡、调节细胞因子以及参与免疫应答如主要组织相容性复合体I类(MHCGI)抗原提呈、T细胞增殖等[2].研究显示蛋白酶体在宿主细胞抗病毒中很重要,但有些病毒可以利用或者破坏蛋白酶体增加自身的复制如A型流感病毒、乙型肝炎病毒、人类星状病毒等[3,4,5].然而,近期也有很多报道表明免疫蛋白酶体也可以帮助宿主细胞抵抗病毒感染,但同时有些病毒会利用免疫蛋白酶体来营造适合自己生存和增殖的环境,如柯萨奇病毒B组3型(CVB3)、丙型肝炎病毒(HCV)等[6,7].
1 、免疫蛋白酶体的结构
1994年,免疫蛋白酶体由于其在MHCGI抗原提呈路径具有重要的作用而得名[8].免疫蛋白酶体主要是由细胞的标准蛋白酶体转变而来的.标准蛋白酶体是由结构性20S蛋白酶体催化核心及调节亚基组成的桶状复合体,如真核细胞内26S蛋白酶体是由20S蛋白酶体催化核心和19S调节亚基组成.结构性20S蛋白酶体共有2个内环和2个外环.每个外环由7个α亚基组成,每个内环由7个β亚基组成[9,10].蛋白酶体中的β1、β2和β5三个亚基分别具有半胱天冬酶样、胰蛋白酶样、胰凝乳蛋白酶样活性.这3个亚基在促炎细胞因子例如干扰素(IFNGγ)或肿瘤坏死因子α(TNFGα)的作用下被LMP2/β1i/PSMB9、MECL-1/β2i/PSMB10、LMP7/β5i/PSMB8亚基替换后[11],即由结构性20S蛋白酶体形成了20S免疫蛋白酶体,20S免疫蛋白酶体的形成如图1.
图1 20S免疫蛋白酶体的形成
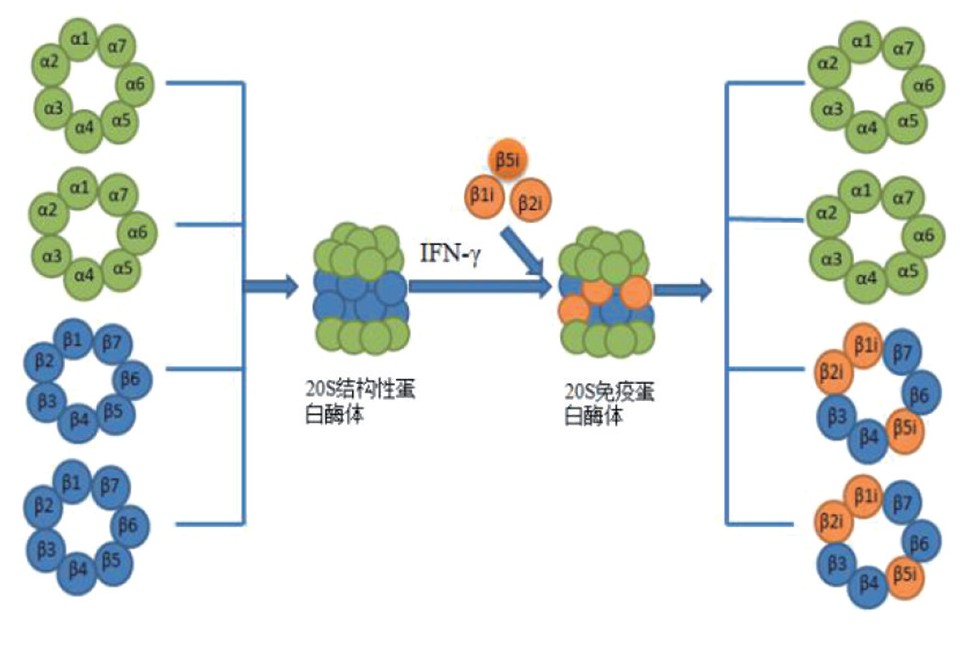
Fig.1 Constitutive20Sproteasomessubunits
β1、β2、β5canbereplacedby LMP2/β1i、MECL-1/β2i、LMP7/β5i underthestimulationof IFNGγtoform20Simmunoproteasome.
2、 免疫蛋白酶体与病毒复制
宿主细胞内的免疫蛋白酶体可以利用其水解活性直接或者间接阻止病毒的复制,减少病毒载量从而使宿主能够抵御病毒的感染.Guardeo等[12]研究表明人类免疫缺陷病毒1型(HIVG1)感染后诱导机体产生的IFN-α可以通过上调免疫蛋白酶体的表达,加速TRIM5α(三方基序5α)的翻转促进TRIM5α辨别HIV-1病毒颗粒,阻止病毒DNA的合成,从而抑制病毒的复制.同时,也有研究发现,鼻病毒感染宿主后诱导产生的IFN-λ可通过激活STAT1信号通路促使免疫蛋白酶体的亚基LMP2和LMP7的表达量上升,进一步上调抗病毒基因MX1和OAS1,抑制病毒复制,从而降低病毒载量[13].然而更有趣的是,有研究报道免疫蛋白酶体可以直接水解病毒关键蛋白阻止病毒复制,Deng等[14]在用酵母双杂交筛选猪瘟病毒感染的猪外周血单核细胞(PBMC)c DNA文库中发现免疫蛋白酶体的亚基PSMB10能与猪瘟病毒NS3蛋白相互作用,并且促进NS3蛋白的降解从而阻止猪瘟病毒的复制.以上研究表明免疫蛋白酶体可以通过控制宿主细胞内的某些蛋白,参与到宿主细胞中的调节通路间接抑制病毒复制.此外,由于病毒的关键结构蛋白是许多病毒感染攻击细胞的基础,因此免疫蛋白酶体可以破坏病毒的关键蛋白,促进其降解.
3 、免疫蛋白酶体与病毒免疫逃逸
宿主细胞可以利用自身的天然免疫抵抗病毒的入侵,MHC-I抗原提呈路径作为宿主细胞识别抗原的一种方式可以参与到宿主的抗病毒反应中.在水疱性口炎病毒感染宿主过程中,病毒的M基质蛋白的球状结构域可与免疫蛋白酶体的催化亚基LMP2的非活性前体相互作用,使LMP2不能够整合到免疫蛋白酶体上破坏免疫蛋白酶体的组装,并且影响CD8+T细胞的活性[15].而免疫蛋白酶体和CD8+T细胞都是宿主细胞进行MHCGI类抗原提呈抵御病毒感染的重要组成部分.这提示水疱性口炎病毒或许可以通过干扰免疫蛋白酶体的组装,阻止MHC-I类多肽的产生破坏MHC-I抗原提呈路径使得CD8+T细胞不能够有效的识别抗原从而使病毒能够逃避宿主的监控和免疫.相类似的是,HCV可以通过蛋白激酶K抑制IFN-γ诱导产生的免疫蛋白酶体,破坏免疫蛋白酶体的组装使细胞毒性T淋巴细胞表位受损,使病毒在细胞内更容易发生免疫逃逸[7].此外,Gan等[16]在研究抗病毒化合物YK73处理的登革热病毒2型(DV2)感染的人肝癌细胞Hep G2时,发现DV2病毒会抑制免疫蛋白酶体亚基LMP2和LMP7的表达阻止结构性蛋白酶体转变为免疫蛋白酶体,从而破坏MHC-I抗原提呈有助于DV2病毒的免疫逃逸.以上结果可知,许多病毒越来越倾向于以免疫蛋白酶体为靶标,破坏免疫蛋白酶体的组装从而调控MHC-I抗原提呈路径,逃避宿主免疫监控.
4 、免疫蛋白酶体与病毒致病性
病毒的致病性与细胞内的组成成分和细胞的免疫应答密切相关.研究报道免疫蛋白酶体参与病毒导致的病理损伤.Kovacsics等[17]将人类原代胎儿星形胶质细胞单独或组合暴露于TNF-α、LPS和IFN-γ中,发现HIV病毒可以通过IFN-γ上调免疫蛋白酶体的表达,促进血红素加氧酶(HOG1)的降解.而HOG1的减少可以增加谷氨酸盐的释放和神经毒性,这将有助于HIV导致的神经认知功能损伤.另外CVB3感染所导致的心肌损伤中也发现了相类似的现象.CVB3感染后,免疫蛋白酶体亚基LMP7可以利用其糜蛋白酶样的催化活性促进LPS介导的p38和ERK1/2的磷酸化,从而上调心脏保护模式识别分子PTX3的表达水平,进而减少炎症因子的释放及降低心肌组织损伤[18].值得关注的是,免疫蛋白酶体在神经类病毒所导致的疾病中也发挥着重要的作用.研究显示LMP7敲除会使被淋巴细胞性脉络丛脑膜炎病毒感染的小鼠浸润活化的淋巴细胞和髓细胞的数目明显减少,同时由于LMP7的敲除阻止了细胞毒性T细胞进入中枢神经系统中从而减少神经退化以及增加小鼠的存活率[19].当然许多病毒对宿主产生致病效果与宿主本身的年龄有关,如CVB3主要导致乳鼠产生心肌炎.近期有研究报道免疫蛋白酶体对于病毒致病性的影响与年龄密切相关.在小鼠腺病毒1型(MAV-1)感染的不同年龄的TKO小鼠(完全缺乏免疫蛋白酶体的小鼠)和正常小鼠中,免疫蛋白酶体对于小鼠腺病毒1型(MAV-1)感染不同年龄小鼠的发病机理的影响不同:缺乏免疫蛋白酶体可以降低新生小鼠肺部由于病毒感染所诱导的IFN-γ的表达水平,增加新生小鼠的死亡率;而免疫蛋白酶体并不影响成年老鼠的炎症反应和MAVG1的发病机理[20].以上研究均表明,免疫蛋白酶体在病毒致病过程中发挥着至关重要的作用.
5 、免疫蛋白酶体与抗病毒治疗
研究显示,免疫蛋白酶体抑制剂可能成为抗病毒药物的一种选择.Althof等[6]使用对于CVB3介导的心肌炎具有高度敏感性的A/J系小鼠作为模型,发现免疫蛋白酶体抑制剂ONXG0914(又称PR-957)可以减少CVB3感染造成的促炎因子的产生,降低心肌组织的损伤.同时,ONX-0914也有助于HIV病毒的抗病毒治疗.研究报道ONX-09可以通过激活HSF1信号通路,减少CDK9(周期蛋白依赖性激酶)的泛素化导致CDK9的积累及磷酸化从而促进RNA聚合酶II磷酸化进而激活潜伏的人类免疫缺陷病毒1型(HIV-1)蛋白质的表达,有助于联合抗逆转录病毒治疗药物对潜伏的HIV病毒进行有效的清除[21].虽然一些蛋白酶体的抑制剂如MG132被证实的确有助于抗病毒治疗[22],但是由于蛋白酶体主要帮助控制细胞内蛋白质的质量,不具有特异性很容易产生副作用.因此对于免疫蛋白酶体的研究将有助于开发更好的抗病毒药物帮助抗病毒治疗.
6 、总结
免疫蛋白酶体作为细胞内的一种特殊的蛋白酶体,对入侵的病毒产生多种效应.一方面,它有助于宿主细胞抑制病毒的复制,另一方面,病毒又可以通过破坏免疫蛋白酶体的组装影响其丰度或者活性,进而干扰MHC-I抗原提呈路径帮助病毒逃避宿主免疫或者影响病毒的致病性.此外,免疫蛋白酶体抑制剂在抗病毒治疗中有越来越多的应用,这表明免疫蛋白酶体或许可以成为对抗病毒的一个很好的靶标.但是对于免疫蛋白酶体抗病毒作用的研究,目前主要集中在免疫蛋白酶体蛋白的表达和MHC- I抗原提呈作用,而免疫蛋白酶体活性的改变及其抗病毒功能的具体调控机制尚不清楚.因此,深入地探究免疫蛋白酶体在抗病毒过程中的分子调控机制,将有助于了解病毒的致病性的同时,也为抗病毒治疗提供新策略.
引用本文格式:徐忆莲,刘琼,黄孝天.免疫蛋白酶体在病毒感染中的作用[J].中国人兽共患病学报,2020,36(10):0-0.DOI:10.3969/j.issn.1002-2694.2020.00.127
参考文献
[1] Goldberg AL.Protein degradation and protection against misfolded or damaged proteins[J].Nature,2003,426(6968):895-899.DOI:10.1038/nature02263
[2] Murata S,Takahama Y,Kasahara M,et al.The immunoproteasome and thymoproteasome:functions,evolution and human disease[J].Nat Immunol, 2018, 19(9):923-931.DOI:10.1038/s41590-018-0186-z
[3] Ren L,Zhang W, Han P,et al.Influenza A virus(H1N1)triggers a hypoxic response by stabilizing hypoxia-inducible factorlalpha via inhibition of proteasome[J].Virology, 2019,530:51-58.DOI:10.1016/j.virol.2019.02.010
[4] Yeom S,Jeong H,Kim SS,et al.Hepatitis B virus X protein activates proteasomal activator 28 gamma expression via upregulation of p53 levels to stimulate virus replication[J].J Gen Virol,2018,99(5):655-666.DOI:10.1099/jgv.0.001054
[5] Casorla-Perez LA,Lopez T,Lopez S,et al.The ubiquitin-proteasome system is necessary for efficient replication of human astrovirus[J].J Virol,2018,92(2):e01809-17.DOI:10.1128/jvi.01809-17
[6] Althof N,Goetzke CC,Kespohl M,et al.The immunoproteasome-specific inhibitor ONX 0914 reverses susceptibility to acute viral myocarditis[J].EMBO Molecular Medicine,2018,10(2):200-218.DOI:10.15252/emmm.201708089
[7] Oh IS,Textoris-Taube K,Sung PS,et al.Immunoproteasome induction is suppressed in hepatitis C virus-infected cells in a protein kinase R-dependent manner[J].Exp Mol Med,2016,48(11):e270.DOI:10.1038/emm.2016.98
[8] Aki M,Shimbara N,Takashina M,et al.Interferon-gamma induces different subunit organizations and functional diversity of proteasomes[J].J Biochem,1994,115(2):257-269.DOI:10.1093/oxfordj ournals.j bchem.a124327
[9] Budenholzer L,Cheng CL,Li Y,et al.Proteasome Structureand Assembly[J].J Mol Bio,2017,429(22):3500-3524.DOI:10.1016/j.jmb.2017.05.027
[10] Huber EM,Basler M,Schwab R,et al.Immuno-and constitutive proteasome crystal structures reveal differences in substrate and inhibitor specificity[J].Cell,2012,148(4):727-738.DOI:10.1016/j.cell.2011.12.030
[11] Arellano-Garcia ME,Misuno K,Tran SD,et al.Interferongamma induces immunoproteasomes and the presentation of MHC I-associated peptides on human salivary gland cells[J].PloS One, 2014,9(8):e102878.DOI:10.1371/journal.pone.0102878
[12] Jimenez-Guardeno JM,Apolonia L,Betancor G,et al.Immunoproteasome activation enables human TRIM5alpha restriction of HIV-1[J].Nat Microbiol,2019,4(6):933-940.DOI:10.1038/s41564-019-0402-0
[13] Dimasuay KG,Sanchez A,Schaefer N,et al.Immunoproteasomes as a novel antiviral mechanism in rhinovirus-infected airways[J].Clin Sci,2018,132(15):1711-1723.DOI:10.1042/cs20180337
[14] Deng S,Yang C,Nie K,et al.Host cell protein PSMB10 interacts with viral NS3 protein and inhibits the growth of classical swine fever virus[J].Virology,2019,537:74-83.DOI:10.1016/j.virol.2019:05.017
[15] Beilstein F,Obiang L,Raux H,et al.Characterization of the interaction between the matrix protein of vesicular stomatitis virus and the immunoproteasome subunit LMP2[J].J Virol,2015,89(21):11019-11029.DOI:10.1128/jvi.01753-15
[16] Gan CS,Lim PJ,Razif MF,et al.Subversion of immunoproteasome subunit expression in dengue virus serotype 2-infectedHepG2 cells[J].Rev Soc Bras Med Tro,2017,50(1):99-103.DOI:10.1590/0037-8682-0207-2016
[17] Kovacsics CE,Gill AJ,Ambegaokar SS,et al.Degradation of heme oxygenase-1 by the immunoproteasome in astrocytes:A potential interferon-gamma-dependent mechanism contributing to HIV neuropathogenesis[J].Glia,2017,65(8):1264-1277.DOI:10.1002/glia.23160
[18] Paeschke A,Possehl A,Klingel K,et al.The immunoproteasome controls the availability of the cardioprotective pattern recognition molecule Pentraxin3[J].Eur J Immunol,2016,46(3):619-633.DOI:10.1002/eji.201545892
[19] Mundt S,Engelhardt B,Kirk CJ, et al.Inhibition and deficiency of the immunoproteasome subunit LMP7 attenuates LCMVinduced meningitis[J].Eur J Immunol,2016,46(1):104-113.DOI:10.1002/eji.201545578
[20] Chandrasekaran A,Adkins LJ,Seltzer HM,et al.Age-dependent effects of immunoproteasome deficiency on mouse adenovirus type 1 pathogenesis[J].J Virol,2019,93(15):e00569-19.DOI:10.1128/jvi.00569-19
[21] Lin J,Zhang X,Lu W,et al.PR-957,a selective immunoproteasome inhibitor,reactivates latent HIV-1 through p-TEFb activation mediated by HSF-1[J].Bioche Pharmacol, 2018,156:511-523.DOI:10.1016/j.bcp.2018.08.042
[22] Miller LK,Kobayashi Y,Chen CC,et al.Proteasome inhibitors act as bifunctional antagonists of human immunodeficiency virus type 1 latency and replication[J].Retrovirology, 2013,10(1):120.DOI:10.1186/1742-4690-10-120





