
生物素是一种有机小分子,可与亲和素或链霉亲和素特异性紧密结合( 解离常数约为 10-15mol / L).利用二者的高亲和性,将生物素标记在靶蛋白上,然后利用亲和素或链霉亲和素,对靶蛋白进行免疫检测、富集和互作蛋白分析,是常用的生物学方法之一。虽然蛋白质的生物素化是细胞内天然存在的一种翻译后修饰,由生物素连接酶( biotin ligase,BirA)催化完成。然而在生物学应用中多采用体外标记法。
即体外将靶蛋白和 N-羟基琥珀酼亚胺酯活化的生物素混合孵育,然后透析除去未结合的生物素,从而获得生物素标记的蛋白质.该体外化学修饰法繁杂,目标蛋白的损失较大,且在一定程度上会破坏蛋白质的构象或功能,不利于后期生物学实验的进行。
在大肠杆菌细胞内,BirA 以乙酰辅酶 A 的亚基生物素羧基载体蛋白( biotin carboxyl carrier protein,BCCP) 为底物,将生物素特异地添加到 BCCP 赖氨酸残基的 ε-NH2上.2012 年 Li 等利用硫氧还蛋白( thioredoxin,TRX) 和麦芽糖结合蛋白( maltose- binding protein,MBP)融合表达的方法,在大肠杆菌内表达出大量可溶性的BirA ( 24. 7 ~ 27. 6 mg / L) 蛋白,并以生物素酶底物肽为底物,Western blot 和 ELISA 检测 BirA 的活性,从而建立了 BirA 催化的体外生物素标记方法.同时,Dorothy等将14 条不同长度的 BCCP 模拟多肽、BirA 和活化的生物素( 生物素-5'-腺苷酸,biotinyl-5'-adenylate) 体外混合,通过质谱和酶动力学实验发现了 BirA 识别的最小多肽底物片段( biotin acceptor peptides,BAP) ,即 14 肽GLNDTFEAQKIEWH.随后人们利用目的蛋白-BAP-BirA融合表达和双质粒共表达的方法,以期获得目标蛋白的体内生物素化标记。然而融合表达获得的融合蛋白较大,若去除 BirA 仍需一步体外蛋白酶解后的纯化,对蛋白的损失较大。而双质粒共表达方法受质粒相容性、多抗性筛选的影响,目的蛋白生物素化水平较低。
单质粒多启动子表达系统是共表达外源蛋白复合物的有效方法之一,每个外源蛋白基因均有单独的启动子,可同时转录产生多个 mRNA 转录物,利于蛋白质翻译的进行,能有效提高外源蛋白的表达量。人己糖胺酶 D ( Hexosaminidase D) 是新发现的一种糖苷酶,底物和生物学作用不明.本实验利用具有两个启动子的共表达质粒 pCDFDuet-1( 图 1) ,将克隆出的 birA基因和连有 BAP 的 hexD 基因构建其中,通过对 HexD-BAP 的表达、纯化、Western blot 检测和酶活分析,拟建立一种快速、简单、高效的生物素标记蛋白质的方法,用于底物蛋白的鉴定、免疫标记等生物学实验。【图1】

1 材料与方法
1. 1 材 料
质粒 pCDFDuet-1 和 pET3c-hexD 由本实验室保存,用于克隆和表达的菌种 Trans5α 和 Escherichia coli BL21( DE3) pLysS 购于北京全式金生物技术有限公司。GeneRulerTM1kb DNA Ladder,限 制性内切酶 EcoR V、Xho I、EcoR I 和 Hind III,T4 DNA 连 接 酶 均 购 于Fermentas 公司。 Protein Marker ( 2 ~ 212 kDa ) 购于Biolabs 公 司。 Prestained Protein Marker 购 于 ThermoScientific 公司。Anti-HexD 抗体由本实验室制备。链霉亲和素-HRP、辣根过氧化物酶标记山羊抗兔 IgG( H+ L) 和镍柱填料( Ni-NTA) 购于北京鼎国昌盛生物技术有限公司。蛋白浓度测定 BCA 试剂盒购于碧云天生物公司。4-MU-O-GalNAc 购于 Sigma 试剂公司。
1. 2 引物设计和重组质粒 pCDFDuet-hexD-BAP 的构建
根据 hexD 基因序列及 BAP 多肽序列( GLNDTFEAQKIEWH) 设计特异性引物 HexD-F 和 HexD-R,序列如表1 所示( 斜体部分分别为 EcoR I 和 Hind III 两个酶切位点,下划线部分为 BAP 多肽的基因序列) .以质粒pET3c-hexD 为模版,经 PCR 扩增得到带有 BAP 基因片段的 hexD 序列。将 PCR 产物和载体 pCDFDuet-1 进行EcoR I 和 Hind III 双酶切,酶切产物用琼脂糖凝胶纯化回收试剂盒回收后,分别取 5 μl hexD-BAP 基因与 3 μl载体,T4 DNA 连接酶于 22℃连接 2h,连接产物转化至Trans5α,接种于含 25 μg / ml 的链霉素的 LB 平板上培养,次日挑取单菌落扩大培养,收集菌体,提取质粒,利用双酶切和 PCR 验证重组质粒 pCDFDuet-hexD-BAP.验证正确的质粒送交金唯智生物科技( 北京) 有限公司测序。
1. 3 birA 基因的克隆及重组质粒 pCDFDuet-hexD-BAP-birA 的构建
取 2 ml 过夜培养的 E. coli Trans5ɑ 菌液,离心,弃上清,STE 缓冲液洗涤 1 次,加入 100μl TE 缓冲液,煮沸 10 min,12 000 r/min 离心 5 min,取上清液作为 birA基因扩增的模版。根据 GenBank 中查到的菌株 E. coliK-12 MG1655 的 briA 基因 DNA 序列设计引物 BirA-F和 BirA-R,序列如表 1 所示( 斜体部分分别为 EcoR V和 Xhol I 两个酶切位点) .经 PCR 扩增得到 birA 目的基因片段,将 PCR 产物和 pCDFDuet-hexD-BAP 进行EcoR V 和 Xhol I 双酶切,酶切产物回收后进行同样方法的连接,转化和重组质粒 pCDFDuet-hexD-BAP-birA的鉴定、测序。【表1】

1. 4 生物素化 HexD 的表达与纯化
表达和纯化方法参考本实验室前期工作,具体如下: 将构建成功的 pCDFDuet-hexD-BAP-birA 重组质粒转化入 BL21( DE3) pLysS 感受态细胞中,37℃ 培养过夜。次日,挑取单菌落活化于含 25 μg/ml 的链霉素和氯霉素的 4 ml LB 液体培养基中,37℃,200 r/min 培养6 h 后,重新接种扩大培养( 37℃,200 r/min 培养约3h) ,待菌液 OD600值达到 0.6,加入 0. 1 mmol/L IPTG 和80 μmol / L 的生物素,诱导蛋白的表达 ( 13℃ ,110 r /min) .诱导 20 h 后,8 000 r / min 离心 10 min 收集菌体,PBS 预洗 1 次后,按照每克湿菌体加入 10ml PBS( pH 7.4) 柱平衡缓冲液( PBS) 的量充分悬浮菌体,在冰浴条件下超声破碎菌体( 160 W,工作 4 s,间歇 7 s,18 min) ,然后 4℃ 、12 000 r / min 离心 30 min.收集上清,将上清液用 0. 22 μm 水膜过滤后,与预装好的且经PBS 预洗过的 Ni-NTA 填料在 4℃ 混合孵育 10 min,让液体经重力流经填料,弃流穿液,再依次用 10 mmol/L,30 mmol / L,40 mmol / L,50 mmol / L 咪唑溶液梯度洗脱镍柱,去掉杂蛋白。最后用 250 mmol/L 的咪唑溶液洗脱镍柱,并收集洗脱的溶液即目的蛋白溶液。采用超滤法( Millipore,截留分子量 10 000 kDa) 对纯化后的蛋白更换缓冲液至低盐 PBS ( pH 7. 4) 浓缩后,进行 12%SDS-PAGE 电泳分析。蛋白浓度采用 BCA 法测定。
1. 5 生物素化 HexD 的 Western blot 检测
蛋白样品经 SDS-PAGE 分离后转移至 PVDF 膜。5% 的牛血清白蛋白组分Ⅵ溶液 37℃ 封闭 1 h,TBST 洗膜后加入链霉亲和素-HRP ( 1∶ 10 000) 4℃ 孵育过夜,TBST ( 25 mmol / L Tris-HCl,pH 7. 5; 50 mmol / L NaCl,0. 1% Tween 20) 洗涤 3 次,10 min / 次,洗涤后加 ECL使 X 光胶片感光。同样的蛋白样品经 SDS-PAGE 分离后转移至 PVDF 膜。用 5% 的脱脂奶粉 37℃封闭 1 h,TBST 洗膜后加入 Anti-HexD 抗体( 1∶ 10 000) ,4℃ 孵育过夜,TBST 洗涤 3 次,10 min/次,加入以 1∶ 5 000 的比例稀释的辣根过氧化物酶标记山羊抗兔 IgG ( H + L)( 0.8 mg/ml) ,室温孵育1.5 h,TBST 洗涤3 次,10 min/次,洗涤后加 ECL 使 X 光胶片感光。
1. 6 生物素化 HexD 的活性测定
酶活测定使用 Gutternigg M 等的方法。在缓冲液( 50 mmol/L NaH2PO4; 100 mmol/L NaCl 和 0.1%牛血清白蛋白,pH 5.5) 中,以5 mmol/L 4-MU-O-GalNAc作为荧光底物,添加 1. 5 μg 酶,反应混合物在 37℃ 下孵育 10 min,然后加入 150μl 的 200 mmol/L 甘氨酸( pH 10.75) 来终止酶促反应。Varioskan Flash 多功能酶标仪检测荧光。以不同浓度 4-MU 的荧光值制作标准曲线。
2 结果与分析
2. 1 hexD-BAP 基因克隆和 pCDFDuet-hexD-BAP 质粒构建
以 pET3c-hexD 为模板,设计 hexD-BAP 的引物( HexD-F,HexD-R) 进行 PCR 扩增,扩增产物进行1. 0% 琼脂糖电泳,结果显示,该 PCR 产物( hexD-BAP 基因片段) 大小约为1 500 bp,与该基因的理论大小一致。
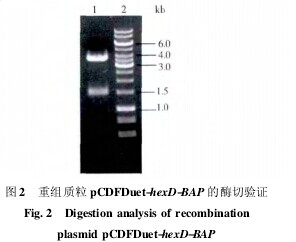
将回收后的 PCR 产物进行 EcoR I 和 Hind III 双酶切后,连入载体 pCDFDuet-1 的多克隆位点 1( multiplecloning sites1,MSC1 ) ,转化至大肠杆菌感受态细胞Trans5ɑ 中,挑取单菌落提取质粒,利用 EcoR I 和 HindIII 进行双酶切验证,酶切后的质粒在相同位置也出现大小一致的片段( 图2) ,表明目的基因片段与表达载体连接正确,重组质粒 pCDFDuet-hexD-BAP 构建成功。DNA 测序结果证实: 扩增序列与 hexD-BAP 的基因序列一致。【图2】
2. 2 birA 基因克隆和 pCDFDuet-hexD-BAP-birA 质粒构建
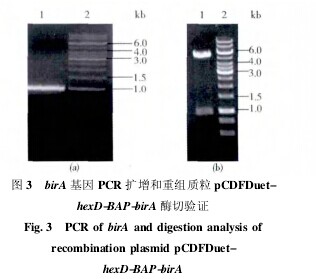
以大肠杆菌 Trans5ɑ 的基因组为模版,用 BirA-F,BirA-R 引物扩增得到 birA 基因片段,PCR 产物电泳分析发现,扩增片段大小为 1 000 bp 左右,与 birA 基因实际大小( 966 bp) 一致( 图 3a) .PCR 产物经 EcoR V 和Xhol I 酶切后连入载体 pCDFDuet-hexD -BAP 的 MSC2中,得 到 重 组 质 粒 pCDFDuet-hexD- BAP-birA.后 经EcoR V 和 Xho I 双酶切和测序证明,片段大小正确( 图3b) ,扩增 birA 基因序列与 Genbank 中序列号为 U00096的 birA 基因序列完全一致,重组质粒构建成功。【图3】
2. 3 生物素化 HexD-BAP 的表达、纯化和鉴定
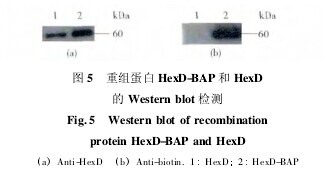
将构建的重组质粒 pCDFDuet-hexD-BAP-birA 转化至大肠杆菌 BL21( DE3) pLysS 中。根据前期 HexD 的表达条件,在菌液培养对数期添加 0.1 mmol/L IPTG 和80 μmol / L 的生物素溶液,诱导结束后,收菌、破菌,用镍柱和超滤纯化富集 HexD-BAP 蛋白,经 SDS-PAGE 分析可见( 图 4) ,诱导后的 HexD-BAP 在 60 kDa 处出现一条带,与预期大小一致( 纯度﹥ 90%,产率 10 g/L) .同时,为了确定 HexD-BAP 是否发生生物素化修饰,我们将其和实验室保留的 HexD 蛋白进行 Westernblot 分析 ( 如图 5 ) .结果显示,与 anti-HexD 孵育后,HexD 蛋白和 HexD-BAP 蛋白均检测到一条 60 kDa 的特异性条带,表明该方法获得的 HexD-BAP 表达正确;与链霉亲和素-HRP 孵育后,HexD-BAP 在 60 kDa 处有一较强的杂交信号,表明该蛋白已被生物素化标记,而HexD 蛋白未有任何信号带。上述结果表明该方法可以正确表达 HexD-BAP 蛋白,且蛋白能被有效地生物素化标记。【图4-5】

2. 4 生物素化 HexD-BAP 的表达、纯化和鉴定
前期试验发现,较高浓度的咪唑可影响 HexD 的糖苷酶活性,因此,我们将 Ni 柱纯化的蛋白超滤至新的缓冲液( 50 mmol/L Tris-HCl,pH7.0) 中,以 HexD 的荧光底物 4-MU-O-GalNAc 对纯化的 HexD-BAP 蛋白进行活性测定( 表 2) .结果表明,与未发生生物素标记的HexD ( 3. 61 nmol / ( min·μg) ) 相比,生物素化标记HexD-BAP 的催化活性为 3. 61 nmol / ( min·μg) .表明生物素化标记不会影响 HexD 的糖苷酶活性,对酶结构的影响较小。【表2】

3 讨 论
生物素是一类小分子( MW = 244. 3) ,与蛋白质结合后,对蛋白质的结构影响较小。生物素标记蛋白是一种常用的蛋白质标记方法。当前存在的生物素标记法,如化学修饰法和 BirA 酶催化法等体外标记方法,均存在不同程度的弊端。因此,本课题拟利用大肠杆菌作为宿主,开发一种简便、可靠的体内生物素标记蛋白质的生产方法。
目前大肠杆菌共表达的方法有三种: 双质粒共转化法; 单质粒多基因串联表达法; 单质粒多基因独立表达法。双质粒共转化的方法中,共存的两个质粒易发生复制效率不一的现象,从而导致两个目的蛋白表达量不一致甚至其中一个不表达。单质粒多基因串联的表达中,多个基因需共同转录,受 mRNA 聚合酶聚合能力和 RNA 稳定性的影响,mRNA 的转录水平不高且不稳定,影响进一步的蛋白质翻译过程。此外,外源基因的在串联组中的位置也会影响表达。单质粒多基因独立表达法是将两个基因甚至多个基因克隆到同一个质粒的两个或多个不同的酶切位点中,转录产生两个或多个独立的 mRNA,再分别翻译形成蛋白质。这种表达系统克服了双质粒共转化表达系统中质粒共存的问题,也有效克服了单质粒多基因串联表达中 mRNA 多顺反子的长度、结构和位置等造成的不利影响.
因此,我们利用单质粒多基因独立表达法,以含有两个多克隆位点的质粒 pCDFDuet-1 作为共表达质粒,将连有 BAP 标签的目的蛋白基因 hexD 和生物素连接酶基因 birA 构建其中,利用质粒上不同的启动子和核糖体 结 合 位 点 ( ribosome-binding site) 进 行 BirA 和HexD-BAP 的分别表达。BirA 酶通过识别 HexD-BAP上的底物序列 BAP,将其生物素化修饰,从而间接实现HexD 在大肠杆菌内的高表达和生物素标记。前人研究表 明,生 物 素 化 反 应 具 有 邻 近 效 应 ( proximity-dependent) ,即 BirA 与靶蛋白共表达后,BirA 对体内靶蛋白的生物素化程度更高,优于体外 BirA 酶催化反应.因此,本实验所开发的蛋白质体内生物素标记方法为生物素标记提供了有力工具。同时,通过酶活试验证实了 BAP 标签和生物素标记并未对 HexD 的活性造成影响,进一步表明生物素体内标记方法的可靠性。该方法只涉及一种质粒的转化、表达和纯化,操作简单,结果可靠,可广泛应用于蛋白质的荧光标记和互作蛋白的筛选等领域。
参考文献
[1]Green N M. Avidin and streptavidin. Methods in Enzymol,1990,184: 51-67.
[2 ] Hatakeyama K,Tanaka T,Sawaguchi M,et al. Microfluidicdevice using chemiluminescence and a DNA-arrayed thin filmtransistor photosensor for single nucleotide polymorphismgenotyping of PCR amplications from whole blood. Lab Chip,2009,9: 1052-1058.
[3]Howarth M,Takao K,Hayashi Y,et al. Targeting quantum dotsto surface proteins in living cells with biotin ligase. Proc Nat AcadSci US,2005,102( 21) : 7583-7588.
[4 ] Larsson C,Rodahl M,H.k F. Characterization of DNAimmobilization and subsequent hybridization on a 2D arrangementof streptavidin on a biotin-modified lipid bilayer supported onSiO2. Anal Chem,2003,75: 5080-5087.
[5 ] Matsunaga T,Maeda Y,Yoshino T,et al. Fully automatedimmunoassay for detection of prostate-specific antigen using nano-magnetic beads and micropolystyrene bead composites,'Beads onBeads'. Anal Chem Acta,2007,597: 331-339.
[6]路静,施前。 生物素标记法分析 MCF-10A 细胞质膜蛋白质。复旦学报( 医学版) ,2010,37( 6) : 710-714.





