随着食品与生物科学技术的不断发展,利用生物技术制造的食品的产量与产值已占食品与生物产业的重要地位。食品生物制造是以基因重组、分子克隆等技术为基础,以生物反应过程、生物物质的分离纯化等技术为重点的工业化和工程化地利用生物体(或部分生物体)生产人类需要的食品的应用技术。下面是食品生物技术论文8篇,供大家借鉴参考。
食品生物技术论文第一篇:PR技术在农产品安全检测中的应用
摘要:表面等离子共振作为近几年在国内发展起来的一种检测技术,具备检测样品用量少、灵敏度高、检测速度快等优点,已被用于环境检测、医疗诊断、药物筛选、蛋白质组学、基因组学等诸多领域。随着技术的发展,广大学者将其与生物技术结合起来,在传感芯片表面修饰不同的特异性抗原抗体及信号放大因子,将表面等离子共振技术不断应用到农产品安全的检测中。通过介绍该技术在农产品中农残药残、动物疾病、微生物、食品添加剂、重金属及转基因检测的应用情况,以期使读者深入了解表面等离子共振技术在食品安全检测的发展现状,为其在该领域的进一步发展提供可以借鉴的资料。
关键词:表面等离子共振; 生物传感; 农产品安全; 检测; 应用;
Applications of SPR Biosensing Technology in Agricultural Products Safety Detection
Wang Tingting Hu Jiandong
Henan Nongda Xunjie Measurement Technology Co., Ltd Department of Electrical Engineering, Henan Agricultural University
Abstract:Surface plasmon resonance(SPR) as a novel technology has advantages of small sample volumes,high sensitivity and fast detection speed, which is widely applied in environmental detection, medical diagnosis, drug screening, proteomics, genomics and many other fields. With its development, SPR is combined with biotechnology, then modified by specific antigen, antibody and signal amplification factor, and widely used in safety detection of agricultural products. The paper introduces the application of SPR in detection of pesticide and medicine residues, animal disease, microbe, food additives, heavy metal and transgenic test in agricultural products. The study could provide certain references for understanding the development status of SPR in food safety test.
0 引言
进入21世纪以来,“毒大葱”、“毒大米”等多次恶性食品安全事件的发生,促使广大人民群众越来越关注餐桌安全,并由此成为全社会关注的焦点。2014年以来国家食品药品监管总局,农业部落实***总书记“四个最严”要求,展开全国食品安全示范城市创建与农产品质量安全县创建的“双安双创”活动,加大市场监管,从源头杜绝不安全因素。2017年第四季度国家食品药品监督管理总局食品安全抽查,不合格样品23766批次,占总提抽查样本的2.2%。其中,食品中超范围、超限量使用食品添加剂问题占不合格总数的27.7%;食品中农兽药残留指标不合格问题占不合格总数的25.1%;食品中微生物污染问题占不合格总数的24.4%;食品中重金属等元素污染问题占不合格总数的3.3%;食品中生物毒素污染问题占不合格总数的1.2%,除此之外还有生物毒素、质量指标的不合格。如何才能吃的放心,吃得安心?除了要从源头抓起,食品的安全性检测也是必不可少的手段之一。目前用于农产品安全检测的技术主要有光谱技术[1]、色谱技术[2,3,4]、生物技术[5]以及微生物培养[6]等方法。而光学表面等离子共振(Surface Plasmon Resonance,SPR)现象首次报道在20世纪初,其作为一种检测方法最早用于检测气体CO2及O2的浓度[7]。随着该技术的不断发展,将其与生物技术结合,形成SPR生物传感器,可以检测所有的具有特异性反应的生物分子。因此,SPR技术越来越展示出其重要的应用价值,并越来越多的参与到农产品安全性的评价工作中[8,9]。
1 SPR原理及引入
表面等离子共振作为一种物理光学现象,最早提出于1902年[10]。其基本原理是当一束P偏振光以一定角度入射到棱镜端面,在金膜与介质界面产生表面等离子波,当入射光波波向量的水平分量和表面等离子体的振动波向量相等时,就会产生表面等离子体谐振。共振时,入射光能量将部分转移到表面等离子体上,使相应的反射光光强减至最弱(图1)。1983年Liedberg等[11]利用表面等离子共振技术研究抗原抗体之间的相互作用,首次将SPR技术应用于生物化学检测。由于SPR技术具有诸多优点,如检测样品用量少、灵敏度高、检测速度快,已被广泛用于环境检测[12]、医疗诊断[13]、药物筛选[14]、蛋白质组学[15]、基因组学[16]等诸多领域。本文将系统综述SPR技术在农产品安全检测的应用现状,以期为保障餐桌安全提供一种新的思路。
2 SPR技术在农产品安全检测中的应用
2.1 SPR技术在农产品中农残药残检测中的应用
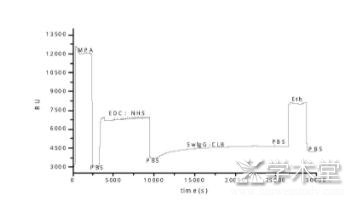
农产品中的农药残留主要指抗生素、杀虫剂类、生长促进剂等。长期使用含有农药残留的农产品对人体健康构成严重威胁。用抗体作为识别分子,检测农药是目前世界上应用最广、最普遍的检测方法。随着科技的发展,抗原抗体的特异性结合通过SPR技术越来越广泛的应用到药物残留的检测,并且其检测限不断降低,检测范围不断增大。Hu[17]将盐酸克伦特罗抗体通过化学方法固定在传感金膜表面,捕捉流经的盐酸克伦特罗抗原,抗原抗体特异性结合,引起金膜表面物质的量的变化及折射率的改变,通过计算响应值(response unit,RU)的变化确定溶液中盐酸克伦特伦的浓度(图2)。研究绘制了盐酸克伦特伦检测的标准曲线,检测限为1.26 ng/mL。石婷等[18]依据抗原抗体反应,通过自组装在金膜表面固定生物分子,用于检测不同质量浓度的氨苄青霉素,最低分辨浓度为1.25 ng/mL。同时分析了样品流速、温度、pH值、离子浓度对检测结果的影响。
图1 SPR检测原理
随着电化学技术及分子印迹技术(Molecular imprinted polymers,MIP)的发展,1998年,Lai等[19]制备出茶碱、黄嘌呤和咖啡MIP-SPR传感器,并首次进行物质检测分析,结果表明该MIP-SPR传感器满足与待测待分析物质的特异性结合,检测限为0.4 mg/mL。自此,MIP-SPR技术在农药、兽药、生物毒素等领域的应用取得了较好发展。2016年,Shrivastav等[20]将银镀在多模光纤上,然后在银膜表层涂上针对于丙溴磷的分子印迹聚合物,制备了一种新型的基于光纤维及生物分子印迹聚合物的SPR生物传感器,当丙溴磷引入时,可与分子印迹聚合物结合,被检物质折射率改变,SPR可以快速准确的捕捉到这种变化,并区分不同浓度的靶标物质。经验证该传感器对丙溴磷的检测其LOD值可达到2.5×10-6μg/L,检测范围为10-4~10-1μg/L。Zhang等[21]制备的卡那霉素分子印迹SPR传感器,对卡那霉素的线性检测范围为1.0×10-7~1.0×10-8moL/L,对蜂蜜中卡那霉素的检测限达到1.20×10-8moL/L。
SPR技术是依靠生物分子膜上物质质量的变化来检测物质的,而几乎所有的农药都是小分子物质,直接检测过程中物资质量变化不明显,限制了SPR技术在农药残留检测中的应用。近年来不断有学者通过信号放大实现检测小分子物质[22,23,24],扩大被检物质的检测范围。Bianco M将特定序列的双链DNA适配体经巯基修饰后,通过自组装单层膜形式固定在传感金膜表面,用于检测真菌代谢物赭曲霉毒素,检测限为0.005 ng/mL[25]。Wang等[26]运用BiacoreT200,在已标记有生物素的CM5芯片表面通过在DNA纳米结构的四面体上定向固化四环素抗体适配体(Apt76),来提高SPR适体传感器的芯片灵敏度及特异性。实测中,蜂蜜中四环素检测的回收率为80.20%~114.3%,最低检测限为0.0069μg/kg。
图2 SPR检测盐酸克伦特罗的响应过程[17]
2.2 SPR技术在动物疾病及微生物检测中的应用
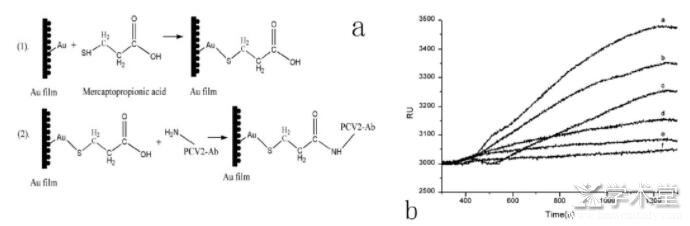
传统的动物疫病检测方法往往具有耗时、灵敏度低、假阳性高以及易受干扰等缺点,难以用于大范围快速准确地检测动物病毒[27]。SPR生物传感器的发展为SPR技术应用于动物疾病检测提供了先决条件。2012年,Hu[28]在自行设计研制的SPR生物分析系统中首次对鸡法氏囊病毒进行检测,通过倍比稀释,各稀释倍数△RU响应值相关系数达到0.97982,同一稀释倍数经多次重述测试,相对标准偏差(RSD)为3.6%,最低检测限为2.5 ng/mL。2014年Hu[29]通过自组装分子膜又对猪圆环病毒Ⅱ(Porcine circovirusⅡ,PCV2)型进行检测(图3),检测限达到0.04 mg/mL,通过样品添加进行回收率试验,回收率范围为81.0%~89.3%。
中国每年因食用含有致病菌的农产品而引起的食物中毒事件占总数的30%~90%,利用SPR技术对细菌、真菌的检测近几年发展较快,灵敏度也不短得到突破。2013年Wang提出基于消减抑制原理的O157H7,有效地避免了因细菌体积过大而超过有效检测范围的缺点提高了对大肠杆菌检测的灵敏度[30]。Naboka等[31]将全内反射椭圆光度法(total internal reflection ellipsometry,TIRE)与LSPR联用,克服了LSPR的隐失场衰减长度的缺点,将霉菌毒素的检测灵敏度提高到0.1 ng/mL。
2.3 SPR技术在农产品添加剂检测中的应用
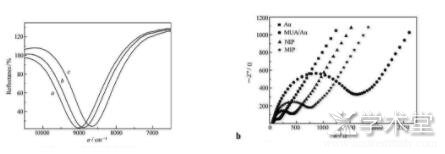
食品添加剂的诞生一方面大大促进了食品工业的发展,并被誉为现代食品工业的灵魂,但与此同时由于一些无良商家的非法或过度添加,致使有食品添加剂引起的食品安全问题被频频爆出。食品添加剂的检测方法近几年也在不断摸索中得到较快发展,表面等离子共振技术以其高灵敏度的性能备受喜爱。周春燕等[32]通过表面引发聚合技术在SPR传感芯片表面固定一层苏丹红Ⅰ印迹凝胶膜,用于检测辣椒粉和腌制品中的苏丹红Ⅰ(如图4),其检出限分别为3.4×10-10moL/L和2.5×10-10moL/L。王曼丽等[33]建立的傅里叶-表面等离子共振传感器用于检测柠檬黄,检出限13μg/L。研究中作者首先将柠檬黄与牛血清蛋白耦合,然后将偶合物通过物理方法固定在SPR传感金膜表面,检测时现将柠檬黄溶液与柠檬黄-小鼠单克隆抗体混合,反应充分后,将反应液流经制备好的芯片,芯片上固定的柠檬黄-牛血清蛋白就会捕捉到多余的未反应的柠檬黄-小鼠单克隆抗体,通过竞争法实现检测柠檬黄。
图3 a检测猪圆环病毒Ⅱ型的自组装分子识别膜;b不同浓度病毒的检测响应曲线[29]
a~g的PCV2浓度分别为10.0、7.5、5.0、2.5、1.0、0.5 mg/m L
2.4 SPR技术在重金属检测中的应用
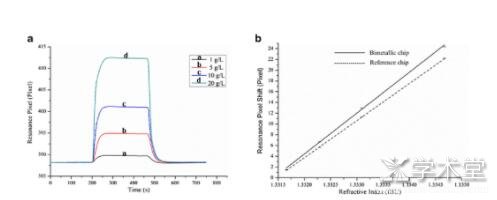
关于重金属污染事件屡见不鲜,从湖南儿童血铅超标事件,到重金属污染“菜篮子”等等,可见重金属污染已影响到我们的健康生活。重金属是指密度大于4.5 g/cm3的金属,常见的有As、Hg、Pb、Cd、Gr、Ag、Ni、Cu、Au等共计45种。提高农产品中重金属的检测技术水平、解决农产品中重金属超标问题,对加强农产品原材料及成品污染的监控具有重要意义。国内外学者在不断完善现有检测方的同时,也引入了新的技术。Pang等[34]通过自制的金银复合膜-SPR进行重金属镉离子(Cd2+)的检测。首先在玻璃上镀上2 nm厚度的铬(Cr)层作为黏附层,然后蒸镀一层40 nm后的银膜,最后是10 nm的金膜,完成复合膜制备,然后将牛血清蛋白(BSA)直接生长在金膜表面,用于检测Cd2+。经测试该金银复合膜-SPR最低检测值为0.01μM(如图5)。Pelossof等[35]利用氯高铁血红素及带有DNA酶的Pb2+提高SPR的灵敏度,对Pb2+的检测限分别为1×10-12moL/L和5×10-15moL/L。
图4 a检测辣椒粉和腌制品中的苏丹红Ⅰ的SPR传感芯片光谱图;b检测辣椒粉和腌制品中的苏丹红Ⅰ的Au、NIP、MIP及MUA/Au的阻抗图谱[32]
2.5 SPR技术在转基因农产品检测中的应用
近几年转基因产品被推上了食品安全的风口浪尖,而如何检测转基因食品也成为广大消费者关心的热点。目前,针对转基因的检测主要有基于蛋白质的检测方法和基于DNA的检测技术两种。利用SPR技术进行转基因片段的研究还不多见。2009年肖守斌[36]将带巯基头的35S启动子寡聚核苷酸探针修饰到镀金的Biacore芯片表面,检测了玉米中的转基因PCR扩增片段。2013年,王婷婷等[37]利用SPR技术检测小麦中的一段转基因序列,比PCR电泳检出值低1倍,且检测线为0.27 mg/L(图6)。随着SPR技术对基因片段转录蛋白质研究的不断深入,也为转基因食品的检测提供了一种思路。
图5 a不同浓度的氯化钠溶液在金银复合膜的传感图;b检测不同折射率的氯化钠溶液的计算曲线[34]
图6 a不同浓度转基因片段的SPR响应曲线;b不同浓度转基因片段的PCR电泳结果[37]
M.DNA marker;1~5样品质量浓度分别为11.5、7.1、3.9、1.9、1.5 mg/L;6.空白对照
3 结论
SPR技术作为一种检测手段,近几年在国内外发展的如火如荼。纵向上不断挖掘SPR技术的在检测上的灵敏度及检测限,横向上SPR的应用领域不断扩大,如医疗、环境、蛋白质及基因组学、食品安全等。但我们也不可回避的是SPR技术也有自身的缺陷。例如小分子的灵敏度有待提高、设备昂贵等。于是SPR技术与其他技术的联用也就应运而生,如LSPR[38]、分子印迹SPR[19,20,21]、电化学SPR[39]、磁光SPR[40]、光子晶体光纤SPR[41]、SERS-SPR技术的联用[42]等等。相信这一技术的不断发展将为其在食品安全检测上的应用提供更为有力的条件。
参考文献
[1]徐霞,成芳,应义斌.近红外光谱技术在肉品检测中的应用和研究进展[J].光谱学与光谱分析,2009,29(7):1876-1880.
[2]傅若农.近几年国内外气相色谱固定相的进展[J].分析试验室,2013,32(5):111-124.
[3]Wang Q J, Yi R H, Mo C H. Determination of Quinolone Antibiotics in Water Using Solid Phase Extraction-High Performance Liquid Chromatography-Fluorescence Method[J].Animal Husbandry and Feed Science,2011,3(2):45-48.
[4]Choma I, Grenda D, Malinowska I, et al. Determination of flumequine and doxycycline in milk by a simple thin-layer chromatographic method[J].JChromatogr B,1999,734(1):7-14.
[5]王磊,张丽杰,吕伟,等.生物素-亲和素放大酶联免疫吸附法测定二乙基磷酸酯类有机磷农药[J].分析化学,2011,39(3):346-350.
[6]杨丽.食品污染物检测技术研究进展与食品安全检测方法标准研究[J].中国食物与营养,2005,3:31-33.
[7]Homola J, Yee S S, Gauglitz G. Surface plasmon resonance sensors:review[J].Sensors and Actuators B:Chemical,1999,54(1-2):3-15.
[8]Rasooly A. Surface Plasmon Resonance Analysis of Staphylococcal Enterotoxin B in Food[J].Journal of Food Protection,2001,64(1):37-43.
[9]Mifumi S, Yoko N, Zhang W, et al. Simple and rapid detection method using surface plasmon resonance for dioxins,polychlorinated biphenylx and atrazine[J].Analytica Chimica Acta,2001,434(2):223-230.
[10]黄智伟,黄琛.表面等离子体共振生物传感器的研究现状[J].传感器世界,2001,7(5):8-12.
[11]Liedberg B, Nylander C, Lundstrom I. Surface plasmon resonance or gas detectlon and biosensing[J].Sensors&Actuators,1983,4:299-304.
[12]Inamori K, Kyo M, Nishiya Y, et al. Detection and quantification of on-chip phosphorylated peptides by surface plasmon resonance imaging techniques using a phosphate capture molecule[J].Analytical Chemistry,2005,77(13):3979-3985.
[13]Chen C Y, Baker S, Darton R. The application of a high throughput analysis method for the screening of potential biosurfactants from natural sources[J].Journal of Microbiological Methods,2007,70(3):503-511.
[14]Altintas Z, Uludag Y, Gurbuz Y, et al. Development of surface chemistry for surface plasmon resonance based sensors for the detection of proteins and DNA molecules[J].Analytica Chimica Acta,2012,7(12):138-144.
[15]Liu X. Performance Improvement for the Wavelength Modulation Surface Plasmon Resonance and Its Application[D].Changchun:Jilin University,2006.
[16]鲍蕾,许艳丽,梁成珠,等.表面等离子共振生物传感器在食品检测中的应用[J].检验检疫学刊,2012,22(4):73-76.
[17]Hu J D, Chen R P, Wang S, et al. Detection of Clenbuterol Hydrochloride Residuals in Pork Liver Using a Customized Surface Plasmon Resonance Bioanalyzer[J/OL].PLOS ONE,2015,10(3):e0122005.
[18]石婷,刘瑾,张婉洁,等.基于SPR生物传感器的抗生素残留检测及影响因素分析[J].天津大学学报,2010,43(3)255-261.
[19]Edward L, Fafara A, Vandernoot V, et al. Surface plasmon resonance sensors using molecularly imprinted polymers for sorbent assay of theophylline, caffeine, and xanthine[J].Canadian Journal of Chemistry,1998,76(3):265-273.
[20]Anand S, Usha S, Gupta B. Fiber optic profenofos sensor based on surface plasmon resonance technique and molecular imprinting[J].Biosensors and Bioelectronics,2016,5(79):150-157.
[21]Zhang L L, Zhu C C, Chen C B, et al. Determination of kanamycin using a molecularly imprinted SPR sensor[J].Food Chemistry,2018,266(15):170-174.
[22]LonL A, Musiek M. D, Natan M. J. Colloidal Au-Enhanced surface plasmon resonance immunosensing[J].Analytical Chemistry,1998,70(24):5177-5183.
[23]Lee W, Son T, Lee C, et al. Ultra-Sensitive Surface Plasmon Resonance Detection by Colocalized 3D Plasmonic Nanogap Arrays[J].Biosensors and Biodetection,2017,3:15-29.
[24]Lee S J, Youn B S, Park J W, et al. SSDNA aptamer-based surface plasmon resonance biosensor for the detection of retinol binding protein 4 for the early diagnosis of type 2 diabetes[J].Analytical Chemistry,2008,80(8):2867-2873.
[25]Bianco M, Sonato A, De Girolamo A, et al. An aptamer-based SPRpolarization platform for high sensitive OTA detection[J].Sensors and Actuators B:Chemical,2017,3(241):314-320.
[26]Wang S, Dong Y Y, Liang X G. Development of a SPR aptasensor containing oriented aptamer for direct capture and detection of tetracycline in multiple honey samples[J].Biosensors and Bioelectronics,2018,109:1-7.
[27]邵康,聂阿秀,韩鹤友.动物重大疾病的光电学传感技术新进展[J].分析科学学报,2017,33(5):729-735.
[28]Hu J D, Li W, Wang T T, et al. Development of a label-free and innovative approach based on surface plasmon resonance biosensor for on-site detection of infectious bursal disease virus(IBDV)[J].Biosensors and Bioelectronics,2012,31(1):475-479.
[29]Hu J D, Wang T T, Wang S, et al. Development of a surface plasmon resonance biosensing approach for the rapid detection of Porcine Circovirus Type2 in sample solutions[J/OL].PLOS ONE,2014,9(10):e111292.
[30]Wang Y X, Ye Z Z, Si C Y, et al. Subtractive Inhibition Assay for the Detection of E.coli O157:H7 Using Surface Plasmon Resonance[J].Sensors,2013,11(3):2728-39.
[31]Naboka A, Al-Rubaye A G, Al-Jawdah AM, et al. Novel optical biosensing technologies for detection of Mycotoxins[J].Optics and Laser Technology,2019,109:212-221.
[32]周春燕,陈长宝,李洁,等.苏丹红Ⅰ印迹表面等离子共振传感器的制备与表征[J].应用化学,2014,31(19):1107-1114.
[33]王曼丽,明华蜜,尹洪宗,等.表面等离子体共振生物传感器的构建及对柠檬黄的检测[J].分析化学研究报告,2014,42(1):53-58.
[34]Pang K, Dong W, Zhang B, et al. A Performance-Enhanced Bimetallic Chip for the Detection of Cadmium Ions with Surface Plasmon Resonance[J].Plasmonics,2016,11(4):1119-1128.
[35]Pelossof G, Telvered R, Willner I. Amplified surface plasmon resonance and electrochemical detection of Pb2+ions using the Pb2+-dependent DNAzyme and hemin/G-quadruplex as a label[J].Analytical Chemisry,2012,84(8):3703-3709.
[36]肖守斌.运用表面等离子共振(SPR)生物传感器检测转基因玉米的研究[J].玉米科学,2009,17(2):38-43.
[37]王婷婷,李伟,魏文松,等.光学表面等离子共振生物传感器检测小麦转基因的研究[J].河南农业大学学报, 2013,47(5):580-583.
[38]Nasrin F, Chowdhury A D, Takemura K, et al. Single-step detection of norovirus tuning localized surface plasmon resonance-induced optical signal between gold nanoparticles and quantum dots[J].Biosens Bioelectron,2018,30(122):16-24.
[39]Chiu N F, Yang C D, Chen C C, et al. Stepwise control of reduction of graphene oxide and quantitative real-time evaluation of residual oxygen content using EC-SPR for a label-free electrochemical immunosensor[J].Sensors and Actuators B,2018,258:981-990.
[40]Otipka P, Vl?e J, Leňák M, et al. Design of MO-SPR sensor element with photonic crystal[J].Photonics and NanostructuresFundamentals and Applications,2018,31:77-80.
[41]Liu H, Wang M, Wang Q, et al. Simultaneous measurement of hydrogen and methane based on PCF-SPRstructure with compound?lm-coated side-holes[J].Optical Fiber Technology,2018,45:1-7.
[42]Meyer Stefan A, AuguiéB, Le Ru Eric C, et al. Combined SPR and SERS microscopy in the Kretschmann configuration[J].Journal of Physics,2012,116(3):1000-1007.
食品生物技术论文第二篇:不同发酵类豆制品中生物胺的含量分析
摘要:目的 调查腐乳、豆酱和豆豉3类豆制品中生物胺含量,初步了解发酵豆制品中生物胺存在情况。方法 参照GB 5009.208-2016《食品安全国家标准食品中生物胺的测定》,采用高效液相色谱法测定6种腐乳、3种豆酱、6种豆豉中的生物胺含量。结果 腐乳中的生物胺含量明显超出另两类,其总生物胺平均含量达472.35 mg/kg;豆酱略高于豆豉,分别为196.77 mg/kg和171.46 mg/kg。腐乳、豆豉和豆酱样品中含量最高的生物胺均是酪胺,腐乳样品中居其次的是腐胺,豆豉和豆酱样品中是章鱼胺,3种品种样品亚精胺和精胺含量均较少。结论 从整体而言, 3类发酵豆制品生物胺含量在安全范围内。
关键词:发酵豆制品; 腐乳; 豆豉; 豆酱; 生物胺;
Investigation and analysis of biogenic amines in different fermented bean products
LI Xuan LIU Qi ZHU Wei-Shan CHEN Jing ZHANG Pei-Na JIANG Li-Wen
Hunan Provincial Key Laboratory of Food Science and Biotechnology College of Food Science and Technology, Hunan Agricultural University
Abstract:Objective To investigate the content of biogenic amines in 3 types of soybean products, such as sufu, soybean paste and fermented soybean paste, and to understand the existence of biogenic amines in fermented soybean products. Methods According to GB 5009.208-2016 National Food Safety Standard-Determination of Biogenic Amine in Food, the content of biogenic amines in 6 kinds of sufu, 3 kinds of soybean paste and 6 kinds of fermented soybean paste was determined by high performance liquid chromatography. Results The content of biogenic amines in sufu was obviously higher than that of the other two types, with the average content of total biogenic amines reaching 472.35 mg/kg. The biogenic amines in soybean paste with 196.77 mg/kg were slightly higher than those in fermented soybean paste with 171.46 mg/kg. The biogenic amines with the highest content in sufu, fermented soybean paste and soybean paste were tyramine, the second was putrescine in sufu, octopamine in fermented soybean paste and fermented soybean paste, and the spermidine and spermine contents in the samples of the three varieties were less. Conclusion On the whole, the biogenic amines in the three fermented bean products were within a safe range.
1 引言
生物胺是一类具有生物活性的、含氨基的低分子质量有机物的总称,包括脂肪族胺、芳香族胺以及杂环胺3类[1]。适量生物胺对人体有一定好处,如增强免疫力、促进生长、抗氧化等,但过量生物胺会对人体产生毒性,引起呕吐、头疼等不良生理反应[2,3]。生物胺的存在主要是蛋白质丰富的原料如豆类、豆类制品经过微生物发酵后水解生产氨基酸,在发酵微生物存在转氨酶的前提下会将氨基酸转化为生物胺,因此这类产品生物胺的问题引起研究学者关注。
关于食品中生物胺的检测方法、存在情况、控制措施等方面的研究较多。如吴迪等[4]优化了以丹磺酰氯作为衍生试剂来检测食品中生物胺的方法。赵庆志等[5]采用高效液相色谱法测定贮藏在不同温度下的整鱼和去内脏的鱼中常见的8种生物胺以及总生物胺含量,探究温度和预处理对鲐鱼中生物胺含量变化的影响。相兴伟等[6]发现辐照对生物胺的生成有一定的抑制作用,且随生物胺种类和辐照强度的变化作用程度大小不一。但由于生物胺种类较多、代谢途径复杂、存在相互转化等,生物胺的限量标准很难确定。目前,国家建立了生物胺的检测方法国家标准,但主要是针对水产品中酪胺和组胺的含量[7,8,9]。
发酵大豆制品以蛋白质丰富的大豆或豆粕作为主要原料发酵后获得,其风味独特而且具有较高的营养价值,因此在消费者饮食生活中离不开发酵豆制品。发酵豆制品主要原料大豆,由于加工工艺差别和产品形态不同,有豆豉、腐乳、豆酱等品种,豆豉、豆酱、腐乳的生产都需要经过较长的发酵时间(至少一个月以上),由于生产过程中复杂的微生物多样性与长时间发酵等因素使发酵豆制品的生物胺存在可能性增加,因此对于豆制品中生物胺含量的调查具有十分重要的意义。
本研究对市场上常见的腐乳、豆酱和豆豉3类豆制品中的生物胺含量进行分析调查,检测不同样品中生物胺存在情况,以便进一步提高改善发酵豆制品的质量及安全性,为该类产品中生物胺的存在及可能的安全限量标准制定提供参考。
2 材料与方法
2.1 样品信息
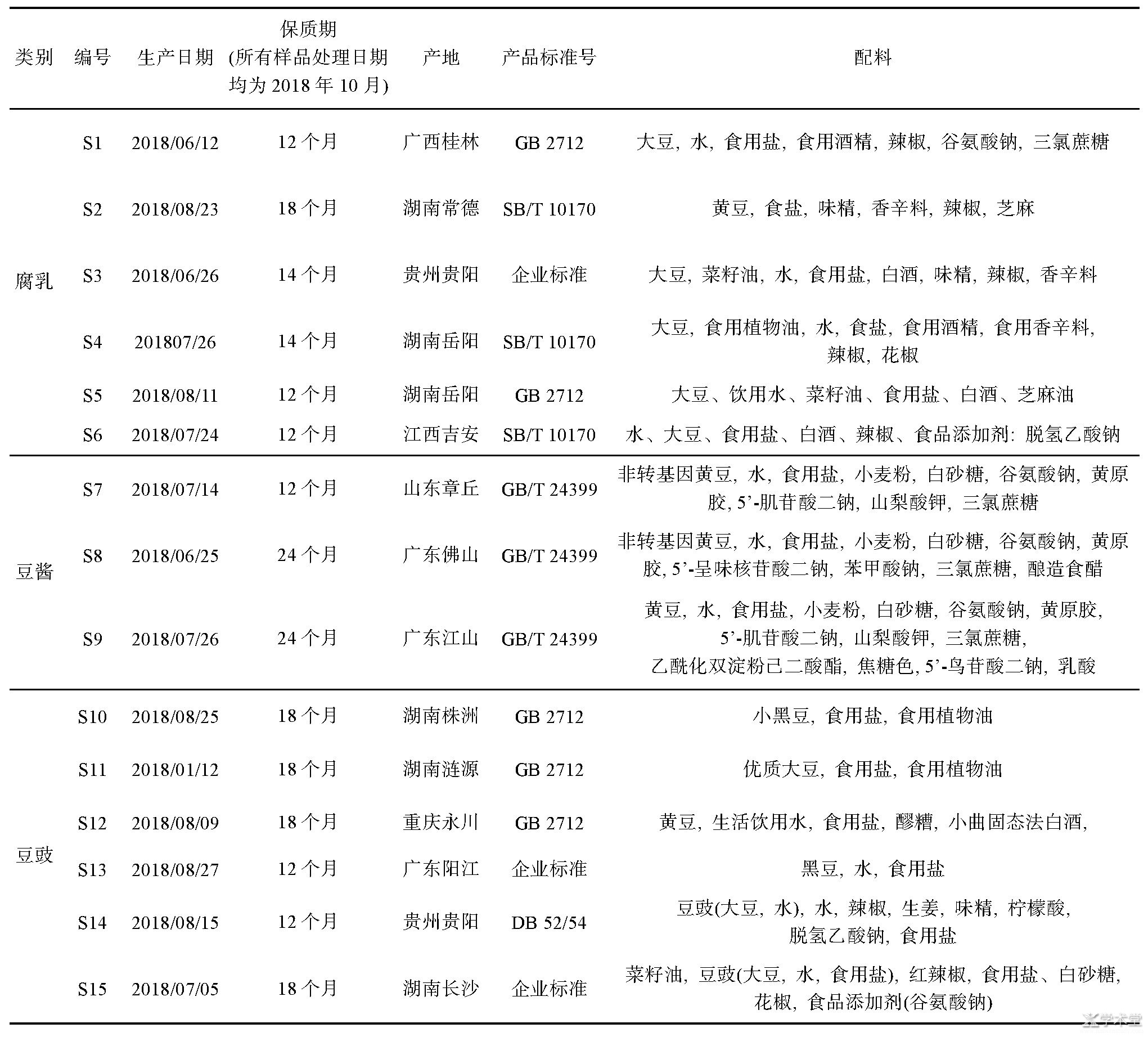
从超市采购了6种腐乳、6种豆豉、3种豆酱,其中腐乳有白腐乳和红腐乳,样1(S1)、样5(S5)、样6(S6)为白腐乳,样3(S3)为红油腐乳,样4(S4)为茶油腐乳,样2(S2)为干腐乳;样7(S7),样8(S8),样9(S9)为豆酱,半固态稠状;豆豉分为干豆豉、水豆豉和油豆豉,其中样10(S10)、11(S11)、12(S12)、13(S13)均为干豆豉,样14(S14)为水豆豉,样15(S15)为油豆豉;样品具体信息见表1。
2.2 仪器与试剂
XW-80A旋涡混合器(上海青浦沪西仪器厂);Agilent1260高效液相色谱仪、ZORBAX SB-C18 Agilent色谱柱(美国Agilent公司)。
乙腈(色谱纯)、正丁醇(分析纯)、无水乙醚(分析纯)、三氯甲烷(分析纯)(国药集团化学试剂有限公司);丙酮(色谱纯,武汉市诺尔施公司);正己烷(色谱纯,天津市化学试剂研究所有限公司)。
2.3 测定方法
参照GB 5009.208-2016《食品安全国家标准食品中生物胺的测定》[10]第一法液相色谱法进行。
2.4 数据处理
每个数据重复3次,用EXCEL 2010对数据进行统计学处理,结果采用X±R表示。
3 结果与分析
3.1 液相色谱分析
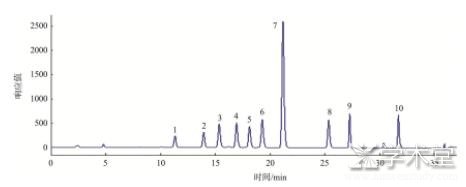
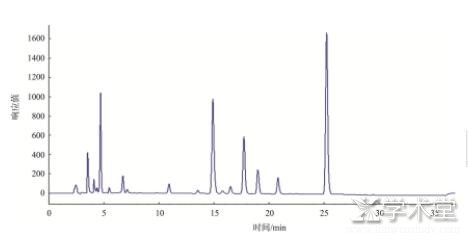
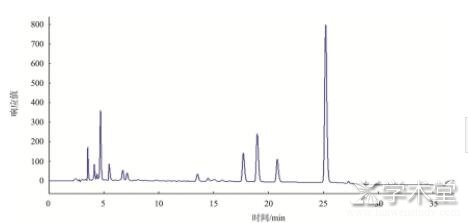
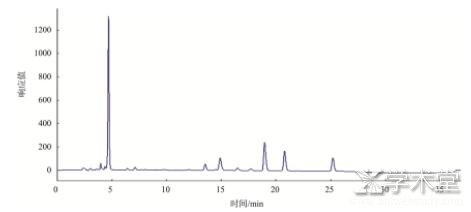
首先对各种生物胺标准品分别进行色谱分析,确定其出峰时间,然后制作混合标准品进行分析,混标色谱图如图1所示。由图1可知,各标准品生物胺出峰时间在10~35 min之间,标号1~10分别为色胺、苯乙胺、腐胺、尸胺、组胺、章鱼胺、内标、酪胺、亚精胺和精胺。3类实际样品的色谱图如图2~4。
3.2 各生物胺的线性关系
表2为各标准品生物胺线性关系。由表2可知,除章鱼胺外,其余标准品相关系数均在0.9990左右,说明该方法精密度较好。章鱼胺是国标改版后才加入的,此前的国标并未包括章鱼胺的测定,且仪器不同、标准品厂家不同,数据测定会存在偏差,因此章鱼胺相关系数不是很好,只简单作为参考。
3.3 3类发酵豆制品中生物胺含量结果
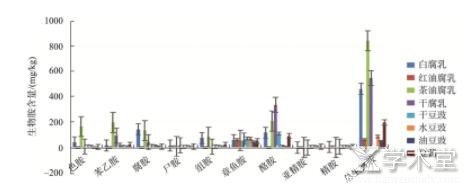
本次样品共6种腐乳、3种豆酱、6种豆豉,检测出10种生物胺。如图5,其中腐乳生物胺含量明显超出另2类,其总生物胺平均含量达472.35 mg/kg;豆酱略高于豆豉,分别为196.77 mg/kg和171.46 mg/kg。而腐乳中茶油腐乳的总生物胺含量为841.74 mg/kg,高于红油腐乳(61.71 mg/kg)和白腐乳(222.94 mg/kg)。茶油腐乳中的色胺和苯乙胺的含量也高于其余所有发酵豆制品。李怡然等[11]发现腐乳中水溶性小肽含量高于豆豉,这可能为腐乳中生物胺的形成提供了更多底物。同时,腐乳中生物胺含量高的原因也可能与其原料有关。腐乳的原料是豆腐,豆酱和豆豉的原料是大豆,相比之下,腐乳中微生物(毛霉为主)的酶系对大豆蛋白质水解程度更加彻底,产品种类更加丰富,游离氨基酸含量越高,形成生物胺的几率也会越高,加上腐乳后期没有杀菌工序,大量细菌微生物协同作用进一步分解氨基酸生成生物胺。
表1 样品信息
图1 混合标准品色谱图
图2 样1腐乳的色谱图
图3 样8豆酱色谱图
图4 样10豆豉色谱图
4类腐乳、3类豆豉和豆酱中含量最高的生物胺均是酪胺,其中干腐乳中的酪胺明显高于其余所有发酵豆制品。8类样品中亚精胺和精胺含量均较少。腐乳、豆豉和豆酱中含量最高的生物胺均是酪胺,腐乳中居其次的是腐胺,豆豉和豆酱中则是章鱼胺,3种品种样品亚精胺和精胺含量均较少,酪氨酸是发酵豆制品中存在较高的一种氨基酸,很容易生成酪氨酸结晶物(即白点),为酪胺的形成提供重要前体物质,腐胺是由鸟氨酸形成。生物胺的形成与微生物污染程度如芽孢杆菌、假单胞菌等存在有关[12,13]。有研究表明,温度可以影响组胺的形成,在14℃以上嗜温细菌可以分泌组氨酸脱羧酶[14]。因此3类发酵豆制品中生物胺种类的差异可能与其微生物有关。
3.4 不同腐乳中生物胺含量结果分析
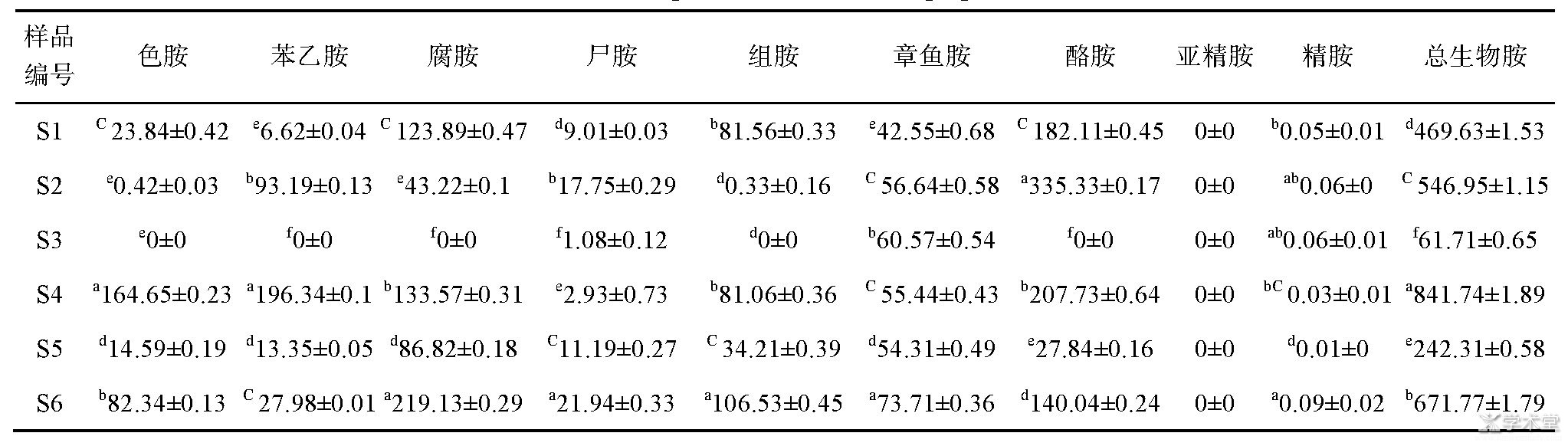
从表3可知,不同腐乳样品生物胺种类及含量存在较大差异,差异造成原因可能与其原料、生产工艺、发酵菌种及储存时间等[15]有关。S3为红油腐乳,从表易知6种腐乳中红油腐乳生物胺含量最低,仅为61.74 mg/kg,试验所检测的10种生物胺其只含有尸胺、章鱼胺和精胺,且尸胺和精胺含量少,对人体可能有害的酪胺和组胺均未检出,推测红油腐乳中可能有抑制生物胺合成的物质存在或红油腐乳加工环节能有效控制生物胺合成。另外干腐乳(S2)是类似传统陶瓷坛腐乳,没有加汤汁和油,水分含量相比其它几种腐乳略低,但酪胺检测结果相对较高,值得进一步探究。
3.5 豆酱中生物胺含量结果分析
从表4可知,3个豆酱样品组胺、酪胺和章鱼胺较多,其中S9黄豆酱生物胺含量最少,主要是其酪胺含量相对其他2种样品较少。豆酱发酵一般采用黄豆和面粉为主要原料,米曲霉为主要发酵剂,并且豆酱一般采用保温发酵和自然晒制,可能与温度适合酪氨酸脱羧酶活性有关。另外结合原料配方,调制后豆酱产品加入一定比例配料,这说明豆酱发酵成熟后产品生物胺可能会更高。根据欧盟规定,食品中酪胺含量不得超过100~800 mg/kg,3种豆酱样品均有一定超出100 mg/kg。我国对于豆酱中酪胺含量的限定还未有明文规定,其安全性有待探究。
表2 标准品线性关系
图5 八类发酵豆制品生物胺含量(n=3)
3.6 豆豉中生物胺含量结果分析
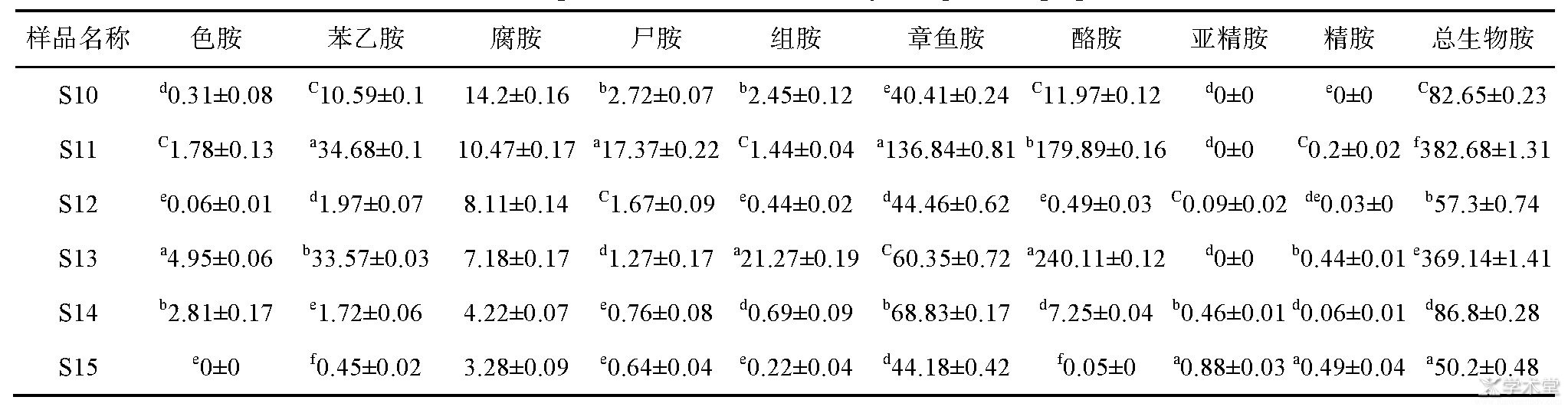
豆豉中生物胺分析结果见表5,6种豆豉中S11和S13这2种干豆豉总生物胺含量较高,主要是2种豆豉酪胺含量较高,其次S11的章鱼胺含量较高、S13的组胺含量较高。韩忠安等[16]发现纯种发酵总生物胺含量要高于自然发酵,张仁凤等[17]发现不同毛霉和米曲霉菌株所产生的生物胺不尽相同,生物胺种类和含量与菌株个体差异性有关,推测该批豆豉样品中生物胺差异可能与其发酵条件及菌株有关。总体而言,水分含量较高且经调味的豆豉(S14、S15)比干豆豉(S10、S11、S12、S13)生物胺含量要低,可能豆豉发酵成熟后经后期加工会影响其生物胺含量,但由于样本较少,具体情况还需进一步探究。
表3 腐乳样品中生物胺含量(mg/kg,n=3)
注:不同字母代表有显著性差异(P<0.05)。
表4 豆酱样品中生物胺含量(mg/kg,n=3)
注:不同字母代表有显著性差异(P<0.05)。
表5 豆豉样品中生物胺含量(mg/kg,n=3)
注:不同字母代表有显著性差异(P<0.05)。
4 结论
从整体上看,几类发酵豆制品均处于安全范围内,但仍存在某些品牌发酵豆制品生物胺含量偏高,甚至是超出欧盟所规定的生物胺含量不得超过100~800 mg/kg。但由于我国并未制定相应标准,并不能说明其有危害,只能推测存在一定风险。其次,本次调查发现红油腐乳生物胺含量明显偏低,尤其是酪胺、组胺并未检出,该现象出现的原因值得探究。
尽管豆豉、腐乳、豆酱都是发酵豆制品,但原料配比及发酵状态(大豆、豆腐、面粉)、发酵主要微生物、产品特性与生物胺形成有密切关系。豆酱中的优势真菌为青霉菌属和毛霉菌属,优势细菌为四联球菌属[18,19],不同发酵方式的酱醅优势细菌存在差异,但同种发酵方式下的酱醅微生物联系紧密[20];豆豉中的优势真菌是酵母菌属和霉菌属,优势细菌以芽孢杆菌为主[21];腐乳中的细菌包括四联球菌属、假单胞菌属、乳酸杆菌属等[22,23,24],其真菌主要是所接种的霉菌。发酵豆制品中生物胺主要由产氨基酸脱羧酶的微生物作用而生成[25]。而从已有研究可知,食品中与生物胺产生相关的主要微生物菌群有假单胞菌属、乳酸菌属和肠球菌等[26,27]。以乳酸菌为例,乳酸菌耐盐性较强,且在pH较低时能产生更多的氨基酸脱羧酶来抵御外界环境的变化,其特点与发酵食品的生产条件相一致。从生物胺的控制出发,对发酵豆制品中微生物的研究十分必要。
参考文献
[1]王光强,俞剑燊,胡健,等.食品中生物胺的研究进展[J].食品科学,2016, 37(1):269-278.Wang GQ, Yu JS, Hu J, et al. Progress in research on biogenic amines in foods[J]. Food Sci, 2016, 37(1):269-278.
[2] Broadley KJ. The vascular effects of trace amines and amphetamines[J].Pharm Ther, 2010, 125(3):363-375.
[3]刘景,任婧,孙克杰.食品中生物胺的安全性研究进展[J].食品科学,2013, 34(5):322-326.Liu J, Ren J, Sun KJ. Research progress on safety of biogenic amines in food[J]. Food Sci, 2013, 34(5):322-326.
[4]吴迪,黄海琴,蔡成岗,等.生物胺丹磺酰氯衍生条件优化研究[J].食品与发酵科技, 2018, 54(1):45-49.Wu D, Huang HJ, Cai CG, et al. Study on optimization of conditions for derivatization of biogenic amine with dansulfonyl chloride[J]. Food Ferment Technol, 2018, 54(1):45-49.
[5]赵庆志,邓建朝,杨贤庆,等.不同贮藏温度下鲐鱼生物胺变化的研究[J].食品工业科技, 2018, 39(4):260-267, 279.Zhao QZ, Deng JC, Yang XQ, et al. Changes of biogenic amines in mackerel under different storage temperatures[J]. Sci Technol Food Ind,2018, 39(4):260-267, 279.
[6]相兴伟,邵宏宏,郝云彬,等.辐照对贮藏过程中大管鞭虾生物胺形成的影响[J].中国食品学报, 2018, 18(1):176-183.Xiang XW, Shao HH, Hao YB, et al. Effect of irradiation on biogenic amine formation in solenocera melantho during storage[J]. J Chin Inst Food Sci Technol, 2018, 18(1):176-183.
[7] GB 2733-2005鲜、冻动物性水产品卫生标准[S].GB 2733-2005 Hygienic standard for fresh and frozen animal aquatic products[S].
[8] US Food and Drug Administration. CPG Sec. 540. 525 Decomposition and histamine raw, frozen tuna and mahi-mahi, canned tuna; and related species, revised compliance policy guide, availability[Z].
[9] European Commission(EC). Commision recommendation of 10 January2003 concerning a coordinated programme for the official control of foodstuffs for 2003(2003/10/EC)[Z].
[10] GB 5009.208-2016食品安全国家标准食品中生物胺的测定[S].GB 5009.208-2016 National food safety standard-Determination of biogenic amines in food[S].
[11]李怡然,赵丽芹,贠婷婷,等.常见大豆制品中水溶性生物活性物质的分析[J].中国食品学报, 2016, 16(2):258-265.Li YR, Zhao LQ, Yun TT, et al. Analysis of water-soluble bioactive substances in common soybean products[J]. J Chin Inst Food Sci Technol,2016, 16(2):258-265.
[12] Jin SM, Seung KC, Hwa YC, et al. Isolation and characterization of Biogenic Amine-producing Bacterium in fermentated soybean-paste[J]. J Microbiol, 2010, 48(2):257-261.
[13] Tsai YH, Kung HF, Lee YH, et al. Histamine contents and histamine-forming bacteria in sufu products in Taiwan[J]. Food Control,2007, 18(5):381-387.
[14]胡鹏,索化夷,阚建全,等.中国传统发酵豆豉中生物胺含量[J].食品科学, 2013, 34(20):108-112.Hu P, Suo HY, Kan JQ, et al. Biogenic amine content of traditionally fermented Douchi[J]. Food Sci, 2013, 34(20):108-112.
[15]刘振锋,魏云潇,张进杰,等.高效液相色谱法检测中国传统发酵豆腐制品中的生物胺[J].中国食品学报, 2010, 10(4):253-259.Liu ZF, Wei YX, Zhang JJ, et al. Determination of biogenic amines in Chinese traditional fermented tofu products by high performance liquid chromatography[J]. J Chin Inst Food Sci Technol, 2010, 10(4):253-259.
[16]韩忠安,罗信旭,杨春艳,等.豆豉中生物胺含量的动态变化研究[J].中国酿造, 2016, 35(5):60-64.Han ZA, Luo XX, Yang CY, et al. Dynamic changes of biogenic amines content in Douchi[J]. Chin Brew, 2016, 35(5):60-64.
[17]张仁凤,陈光静,杨万明,等.豆豉发酵常用毛霉和米曲霉菌株产生物胺能力的评价[J].食品与发酵工业, 2017, 43(9):15-21.Zhang RF, Cheng GJ, Yang WM, et al. Evaluation of biogenic amines produced by Mucor and Aspergillus oryzae in Douchi fermentation process[J]. Food Ferment Ind, 2017, 43(9):15-21.
[18]姜静.自然发酵豆酱微生物多样性及品质分析[D].沈阳:沈阳农业大学, 2018.Jiang J. Analysis on microbial diversity and quality of naturally fermented soybean paste[D]. Shenyang:Shenyang Agricultural University, 2018.
[19]张鹏飞,乌日娜,张平,等.酱醅与豆酱微生物关系研究[J].食品工业科技, 2019, 40(7):101-106, 113.Zhang PF, Wu RN, Zhang P, et al. Study on the microbial relationship between fermented grains and soy sauce[J]. Sci Technol Food Ind, 2019,40(7):101-106, 113.
[20]姜静,解梦汐,安飞宇,等.应用MiSeq测序分析自然发酵豆酱酱块中微生物的多样性[J].食品工业科技, 2018, 39(16):92-97.Jiang J, Xie MX, An FY, et al. Analysis of microbial diversity in naturally fermented soybean paste by MiSeq[J]. Sci Technol Food Ind, 2018,39(16):92-97.
[21]樊敏,杨萍,胡萍,等.贵州豆豉粑中微生物多样性研究[J].中国酿造,2019, 38(3):81-88.Fan M, Yang P, Hu P, et al. Microbial diversity in Douchiba from Guizhou[J]. Chin Brew, 2019, 38(3):81-88.
[22]陈颖慧. PCR-DGGE分析不同品牌腐乳中细菌的多样性[J].中国调味品, 2017, 42(7):29-32.Chen YH. Analysis of bacterial diversity in sufu from different brands by PCR-DGGE[J]. Chin Cond, 2017, 42(7):29-32.
[23]刘亚栋.利用16S r DNA测序的方法鉴定腐乳中微生物的种类多样性[D].济南:山东师范大学, 2017.Liu YD. Identification of microbial species diversity in sufu b 16S rDNA[D]. Jinan:Shandong Normal University, 2017.
[24]张志超,罗剑鸣,殷光玲.商业化腐乳中乳酸菌的分离与鉴定[J].食品安全导刊, 2018,(18):154-156.Zhang ZC, Luo JM, Yin GL. Isolation and identification of lactic acid bacteria from commercial sufu[J]. China Food Saf Magaz, 2018,(18):154-156.
[25]景智波,田建军,杨明阳,等.食品中与生物胺形成相关的微生物菌群及其控制技术研究进展[J].食品科学, 2018, 39(15):262-268.Jing ZB, Tian JJ, Yang MY, et al. Research progress on microbial flora related to biogenic amine formation in food and its control technology[J].Food Sci, 2018, 39(15):262-268.
[26]王永丽,李锋,陈肖,等.传统发酵肉制品中生物胺形成机理及检测控制技术[J].肉类研究, 2013, 27(6):39-43.Wang YL, Li F, Chen X, et al. Formation mechanism and detection and control technology of biogenic amines in traditional fermented meat products[J]. Meat Res, 2013, 27(6):39-43.
[27]张吉明,赵燕梅,许庆方.产生物胺乳酸菌研究概述[J].山西农业科学, 2014, 42(5):521-525.Zhang JM, Zhao YM, Xu QF. Review on the induction of producing amines of Lactic acid bacteria[J]. J Shanxi Agric Sci, 2014, 42(5):521-525.