摘 要: 【目的】为鱼类生殖生理学和繁殖生物学研究提供参考。【方法】以稀有鮈鲫为试验动物,采用mTOR通路抑制剂雷帕霉素处理3月龄雌性个体至4月龄,正常饲养至5月龄,以同时注射等量不含雷帕霉素的稀释剂和二甲基亚砜(DMSO)为对照,测定不同阶段性腺指数(GSI)和卵巢发育情况,Real-time PCR检测卵子发生相关基因的表达情况。【结果】3、4、5月龄对照组和3月龄处理组卵巢具有Ⅳ时相卵母细胞,4月龄处理组只具有Ⅰ、Ⅱ时相卵母细胞,5月龄处理组卵巢中观察到Ⅲ时相卵母细胞;处理组GSI显着低于对照组;处理组中foxl2、fshr、cyp11a1、cyp19a1a和bmp15表达显着低于对照组,figlα在处理组中表达显着高于对照组。【结论】雷帕霉素处理导致稀有鮈鲫卵母细胞发育停滞在Ⅱ时相,推测mTOR通路可能通过调节类固醇发生和TGFβ信号通路促进卵母细胞的发育和成熟。
关键词 : 雷帕霉素;卵子发生;抑制剂;基因表达;稀有鲍鲫;
Abstract: 【Objective】The paper was to provide a reference for the study of fish reproductive physiology and reproductive biology.【Method】Gobiocypris rarus was used as experimental animals,mTOR pathway inhibitor rapamycin was employed to treat the 3-month-old female rare G.rarus.The treatment was continuous for 1 month and then normal feeding for 1 month.The GSI was calculated and the ovarian histology was observed at different experimental stages.Expression of oogenesis related genes was detected using Real-time PCR.【Result】Histologically,stage Ⅳ and earlier oocytes in 3,4,5-monthold control groups and 3-month-old treatment groups,stage Ⅰ and Ⅱ and earlier oocytes in 4-month-old treatment groups,stage Ⅲ and earlier oocytes in 5-month-old treatment groups,could be observed.GSI and gene expressions of foxl2、fshr、cyp11a1、cyp19a1a and bmp15 were significantly lower in treatment groups than control groups,while expression of figlα was significantly higher in treatment groups than control groups.【Conclusion】Therefore,rapamycin treatment resulted in oogenesis arrested at stage Ⅱ oocytes in rare G.rarus.We suspected that mTOR pathway possibly promotes oocytes development and maturation by regulating steroidgenesis related genes and TGFβpathway genes.
Keyword: rapamycin; oogenesis; inhibitor; gene expression; rare G.rarus;
0、 引言
【研究意义】稀有鮈鲫(Gobiocypris rarus)属鲤科鮈鲫属,是中国特有的一种小型鱼类,被中国野生动物红皮书和中国物种红色名录列为濒危鱼类,其个体小、易于养殖,已被多个实验室用作科学研究试验动物。实验室养殖条件下,稀有鮈鲫性成熟快,周年多次产卵,是研究鱼类卵子发生的理想材料。卵子发生是卵原细胞形成具有受精能力卵母细胞的过程,是物种传宗接代和繁衍生息的基本前提。卵子发生在多个信号通路的共同调控下进行,mTOR通路是调控其发生的主要信号通路之一。用mTOR通路抑制剂雷帕霉素处理稀有鮈鲫,研究该通路在鱼类卵子发生中的作用,对鱼类生殖生理学和繁殖生物学研究有重要参考价值。【前人研究进展】在静止期卵母细胞与原始滤泡颗粒细胞中,mTOR表达异常可导致细胞内蛋白合成增加,卵母细胞发育及颗粒细胞增值分化,使原始滤泡细胞被激活,引发原始滤泡库过早耗竭,从而导致卵巢储备能力降低。mTOR受2个蛋白分子(TscI、TscII)构成的异二聚体复合物的负反馈调控[1]。如小鼠卵母细胞中特异敲除TscI和TscII,原始滤泡细胞过早激活[2,3]。采用雷帕霉素(Rapamycin)抑制mTOR活性则导致原始滤泡细胞激活率下降[4],这对卵子的发生影响较大。【研究切入点】鱼类是研究脊椎动物卵子发生的重要模型,但mTOR通路在鱼类卵子发生中的功能尚未得到验证。【拟解决的关键问题】采用mTOR通路抑制剂雷帕霉素处理稀有鮈鲫,研究该通路在鱼类卵子发生中的作用。
1、 材料与方法
1.1、 试验材料
试验所用稀有鮈鲫从西南大学淡水鱼类资源与生殖发育教育部重点实验室引进,在贵州省农业科学院水产研究所实验室培育繁殖,于自然光周期下26℃恒温循环水系统中饲养。混合投喂丰年虫和升索微粒子饲料,早晚各1次。
雷帕霉素(S1039)购自美国Selleck生物科技有限公司,根据其说明书进行使用。
1.2 、药物处理
将雷帕霉素溶解于二甲基亚砜(DMSO)中,配置浓度为100 mg/mL的储存液。将储存液溶解于稀释剂5.2%吐温-80和5.2%聚乙二醇400溶液混合液中,配置浓度为1.0mg/mL的工作液,过滤灭菌,按每份1mL分装于灭菌管中,-80℃保存。雷帕霉素处理采用腹腔注射方法,注射剂量为1g鱼注射5μL工作液,对照同时注射等量不含雷帕霉素的稀释剂和DMSO。从稀有鮈鲫3月龄(已达性成熟)开始注射,只注射雌鱼(此时雌鱼腹部膨大,可用此区分雌雄鱼),隔7d注射1次,持续至4月龄停止,正常饲养至5月龄。分别在3、4、5月龄时随机抽取6尾鱼观察其性腺发育情况。
1.3、 卵巢组织学观察
称量3、4、5月龄试验组和对照组鱼的体重后,取出性腺称重,并计算性腺指数(GSI=性腺重/体重×100%)。将称重后的性腺迅速进行波恩氏液固定过夜后进行石蜡包埋、切片。制片后二甲苯脱蜡,梯度酒精复水,苏木素、伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片,采用尼康电子显微镜观察和成像。
1.4、 基因表达检测
从NCBI(http://www.ncbi.nlm.nih.gov/)下载稀有鮈鲫foxl2(JN200819)、fshr(KC464362)、cyp11a1 (JN858106)、cyp19a1a(GU220394)、bmp15(KF934186)、figlα(KF318206)基因开放阅读框序列。通过NCBI系统中Primer-BLAST在线软件设计基因转录表达检测引物,片段长度150~300bp。引物合成由北京擎科新业生物技术有限公司完成。
提取3、4、5月龄试验组和对照组稀有鮈鲫性腺总RNA,DNA酶Ⅰ去除DNA污染。第一链cDNA由Takara反转录试剂盒合成。Real-time PCR在实时定量PCR仪上进行,具体操作参照SYBR Premix Ex TaqTM II试剂盒说明书。Real-time PCR所用引物见表1。管家基因β-actin作为内参,目标基因mRNA的相对表达水平采用公式R=2-△△Ct方法计算[5],结果表示为Ct值的平均值±标准偏差(Mean±SD),采用SPSS进行显着性分析,组间差异采用单因素方差(one-way ANOVA)分析Duncan’s post-hoc检验,显着性水平为P<0.05。
表1 Real time PCR引物

2 、结果与分析
2.1、 卵子的发生情况
3月龄时检测发现,稀有鮈鲫卵巢已具有Ⅳ时相卵母细胞(图1a、d);雷帕霉素处理1月后(4月龄),卵巢中只有Ⅰ、Ⅱ时相卵母细胞(图1b),而对照组中具有Ⅳ时相卵母细胞(图1e);正常饲养1个月后(5月龄),处理组卵巢中观察到Ⅲ时相卵母细胞(图1c),而对照组中始终具有Ⅳ时相卵母细胞(图1f)。从图2看出,处理组3、4、5月龄的性腺指数与对照组3月龄间无显着差异,4月龄处理组显着低于5月龄处理组,4月龄和5月龄处理组均显着低于相应的对照组。
图1 雷帕霉素处理稀有鮈鲫的卵巢组织
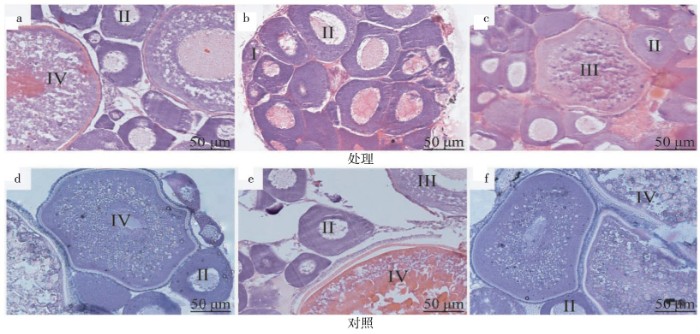
Fig.1 Ovarian tissue of rare G.rarus treated with rapamycin
2.2、 卵子的相关基因表达
从图3看出,foxl2、fshr、cyp11a1、cyp19a1a和bmp15的基因相对表达量在3、4、5月龄对照组和3月龄处理组间无显着差异,4月龄处理组显着低于5月龄处理组,4月龄和5月龄处理组均显着低于相应对照组;3、4、5月龄对照组的figlα与3月龄处理组间无显着差异,4月龄处理组显着高于5月龄处理组,4月龄和5月龄处理组均显着高于相应对照组。
图2 雷帕霉素处理稀有鮈鲫的性腺指数
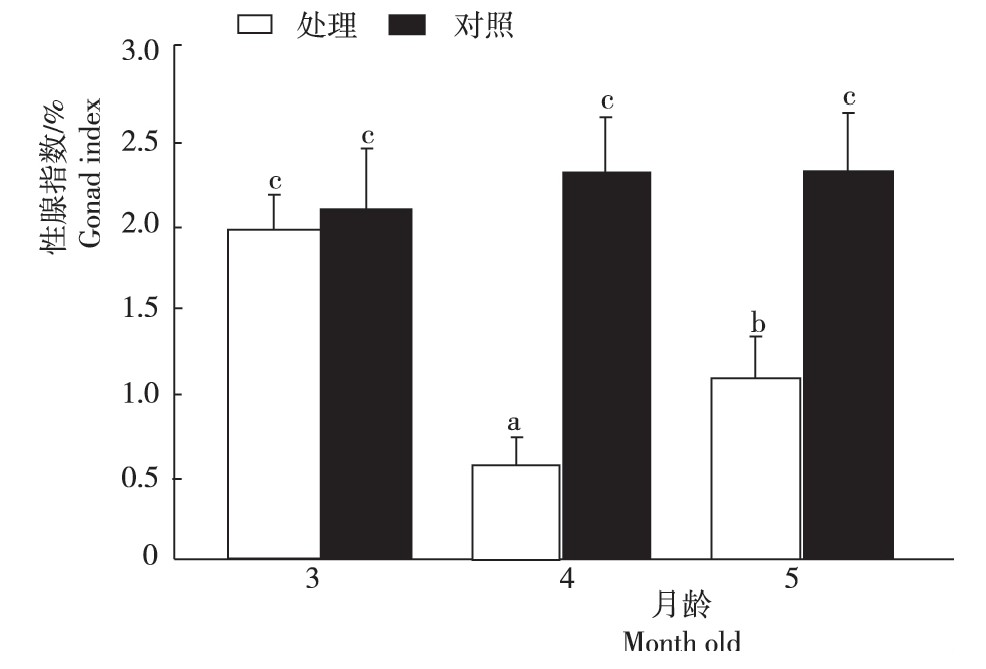
Fig.2 The gonad index of rare G.rarus treated with rapa-mycin
注:不同小写字母表示差异达显着水平(P<0.05),下同。
Note:Different lowercase letters indicate significance of difference at P<0.05level.The same below.
图3 雷帕霉素处理稀有鮈鲫卵子发生相关基因表达
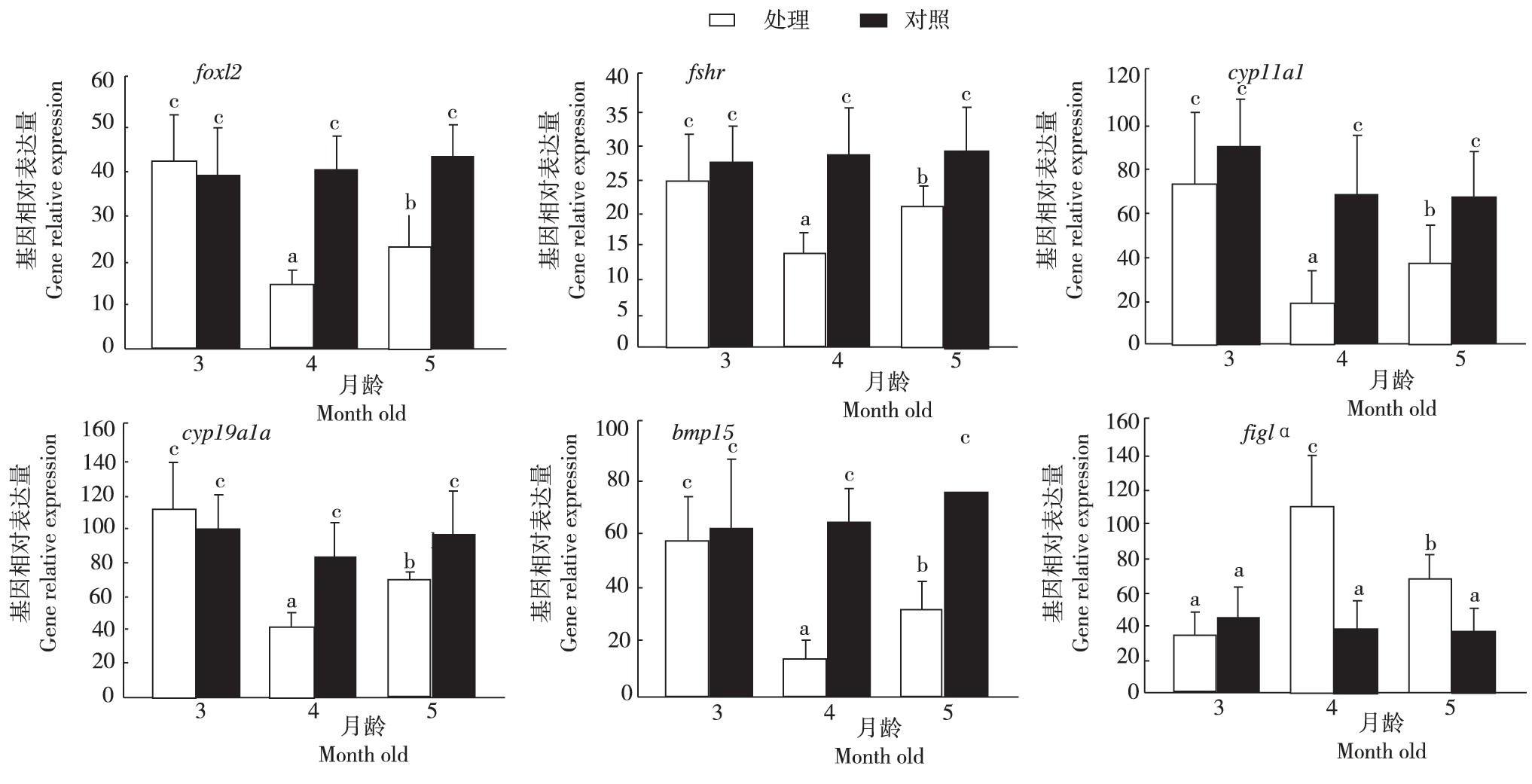
Fig.3 Expression of genes related to oogenesis in rare G.rarus treated with rapamycin
3、 讨论
研究验证了雷帕霉素处理对稀有鮈鲫卵子发生影响,进一步证明mTOR通路在鱼类卵子发生中的作用。雷帕霉素处理后,稀有鮈鲫卵子发生出现障碍,卵母细胞只能发育至II时相,性腺指数显着低于对照组。这与小鼠类似研究结果相似,即无论是随着小鼠年龄增长而引起的卵巢储备功能降低或化疗药物所导致的卵巢功能不全,应用mTOR抑制剂均能抑制原始滤泡的激活,使卵子发生不能正常进行[4,6,7]。在小鼠初级滤泡颗粒细胞体外培养过程中,使用雷帕霉素处理后,颗粒细胞的增殖率呈剂量依赖性下降;并且停滞在有丝分裂G1期的GCs比例也呈剂量依赖性增加,仅有小部分GCs进入分裂期,且细胞分裂异常,抑制颗粒细胞活化[8,9]。说明,mTOR信号通路在脊椎动物卵巢发育中的作用比较保守,该通路被抑制时,卵子发生受阻,卵母细胞不能正常发育。在小鼠研究中还发现,通过特异性敲除卵巢颗粒细胞中Tsc1基因(mTOR信号通路的一个重要因子)后,颗粒细胞内mTOR磷酸化水平提高,信号通路过度激活,初级卵泡和排卵数增加[10],进一步证明mTOR信号通路对脊椎动物卵子发生的重要性。此外,雷帕霉素抑制卵母细胞发育不是永久的,当停止处理后,卵子发生得以恢复。
Foxl2是1个转录因子,能够调控脊椎动物类固醇发生相关的多种催化酶编码基因表达,对卵巢发育必不可少,缺失后,卵巢发育不能正常进行,会逆转为精巢[11,12,13];Fshr是促性腺激素受体,主要在动物卵巢颗粒细胞中表达,对卵母细胞发育至关重要[14,15];Cyp11a1和Cyp19a1a是类固醇发生过程中的催化酶,也主要在动物卵巢颗粒细胞中表达,其催化产物促进卵巢发育,缺一不可[13,16,17,18,19];Bmp15是TGFβ家族成员之一,敲除鱼类该基因,卵巢颗粒细胞不能形成,卵母细胞不能维持[16,20];Figlα是最早表达的生殖细胞特异的性转录因子之一,对卵泡的早期发育有重要的调控作用,主要在鱼类II时相卵母细胞中表达[21,22,23]。在4月龄和5月龄处理组中,foxl2、fshr、cyp11a1和cyp19a1a的表达都显着低于对照组,说明雷帕霉素处理对类固醇发生通路具有一定抑制作用,从而影响卵母细胞发育。bmp15表达的下调说明雷帕霉素处理也影响到TGFβ信号通路的调控,但其间的调控关系和bmp15表达下调的原因还有待进一步研究。foxl2、fshr、cyp11a1和cyp19a1a基因均在动物卵巢体细胞中表达,而Figlα则在生殖细胞中高表达,主要定位于II时相卵母细胞。雷帕霉素处理后,卵母细胞发育停留在II时相,此时的II时相卵母细胞占比较高,显然figlα表达出现上调。
4 、结论
采用mTOR通路抑制剂雷帕霉素处理成年稀有鮈鲫,导致其卵子发生出现障碍。类固醇发生相关基因foxl2、fshr、cyp11a1、cyp19a1a和TGFβ信号通路基因bmp15表达在处理组中显着下调,生殖细胞特异性转录因子figlα表达出现上调。说明,mTOR通路可能通过调节类固醇发生和TGFβ信号通路调控鱼类卵子发生,促进卵母细胞的发育和成熟。
参考文献
[1]LAPLANTE M,SABATINI D M.mTOR signaling in growth control and disease[J]Cell,2012,149(2):274-293.
[2]ADHIKARI D,FLOHR G,GORRE N,et al.Disruption of Tsc2in oocytes leads to overactivation of the entire pool of primordial fllicles[J].Mol Hum Reprod,2009,15(12):765-770.
[3]ADHIKARI D,ZHENG W,SHEN Y,et al. Tsc/mTORC1signaling in oocytes governs the quiescence and activation of primordial fllicles[J][ Hum Mol Genet,2010,19(3):397-410.
[4]ZHANG J,LIU W,SUN X,et al. Inhibitin of mtor signaling pathway delays fllicle formation in mice[J].J Cell Physiol,2017,232(3):585-595.
[5]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J]. Methods,2001,25(4):402-408.
[6]DOU X,SUN Y,LI J,et al. Short-term rapamycin treatment increases ovarian lifespan in young and middle-aged female mice[J] Aging Cell,2017, 16(4):825-836.
[7]GOLDMAN K N,CHENETTE D,ARJU R,et al.mTORC 1/2inhibition preserves ovarian function and fertilit during genotoxic chemotherapy[J].Proc Natl Acad Sci U S A,2017,114(12):3186-3191.
[8]ALAM H,MAIZELS E T,PARK Y,et alolliclestimulating hormone activation of hypoxia-inducible factor-1by the phosphatidylinositol 3-kinase/AKT/Ras homolog enriched in brain(Rheb/mammalian target of rapamycin (mTOR)pathway is necessary for induction of select protein markers of fllicular dfrertiation[J.J Biol Chem,2004,279(19):19431-19440.
[9]YU J,YABAA,KASIMAN C,et al.mTOR controls ovarian fllicle growth by regulating granulosa cell prolifeatin[J.Plos One,2011,6(7):e21415.
[10]HUANG L,WANG Z B,JIANG Z Z.et al. Specific disruption of Tsc1in ovarian granulosa cells promotes ovulation and causes progressive accumulation of corpora lutea[J].PlosOne,2013,8(1):e54052.
[11]BOULANGER L,PANNETIER M,GALL L,et al.FOXL2 is a female sex-determining gene in the goat[J]. Curr Biol,2014,24(4):404-408.
[12]YANG Y J,WANG Y,LI Z,et al. Sequential,Divergentand Cooperative Requirements of Foxl2aand Foxl2bin Ovary Development and Maintenance of Zebrafish[J]Genetics,2017,205(4):1551-1572.
[13]ZHANG X,LI M,MA H,et al.Mutation of foxl2or cyp 19a1aResults in Female to Male Sex Reversal in XX Nile Tilapia[J]. Endocrinology ,2017,158(8)-2634-2647.
[14]ZHANG ZHIWEI,LAU SHUK-WA,ZHANG LINGLING,et al. Disruption of Zebrafish Fllil-Stimulating Hormone Receptor(Fshr)But Not Luteinizing Hormone Receptor (Lhcgr)Gene by TALEN Leads to Failed Follicle Activation in Females Followed by Sexual Reversal to Males[J] Endocrinology,2015, 156(10):3747-3762.
[15]CHU L,LI J,LIU Y,et al. Gonadotropin Signaling in Zebrafish Ovary and Testis Development:Insights From Gene Knockout Study[J].Mol Endocrinol,2015,29(12):1743-1758.
[16]DRANOW D B,HU K,BIRD A M,et al .Bmp15Is an Oocyte Produced Signal Required for Maintenance of the Adult Female Sexual Phenotype in Zebrafish[J] PLoS Genet,2016, 12(9):e1006323.
[17]LAU E S,ZHANG Z,QIN M,et al.Knockout of Zebrafish Ovarian Aromatase Gene (cyp19a1a)by TALEN and CRISPR/Cas9 Leads to Al-male Offspring Due to Failed Ovarian Differentiation[J].Sci Rep ,2016(6):37357.





