摘 要: 氧化石墨烯现已成为生物医学应用中最有前途的生物材料, 具有较高的载药能力, 在基因递送、生物成像、光动力治疗、免疫增强、抗菌作用上都已成为研究热点。主要介绍氧化石墨烯在生物医学领域的应用研究进展。
关键词: 氧化石墨烯; 载药; 生物成像; 免疫增强剂; 生物医学;

Abstract: Graphene oxide has become the most promising biomate
rial in biomedical applications.Due to its high drug loading capacity, it has been a research hotspot in gene delivery, bioimaging, photodynamic therapy, immune enhancement and antibacterial activity.In this review, the research progress of graphene oxide in biomedicine was mainly introduced.
Keyword: graphene oxide; drug loading; bioimaging; immune enhancement; biomedicine;
0 引言
氧化石墨烯 (graphene oxide, GO) 是迄今发现的最薄、最牢固的材料, 具有极高的电、热、光传导性, 在电子、生物医学等领域有着广泛的应用前景[1]。石墨烯经氧化后, 其上含氧官能团增多而使性质较原来的石墨烯更加活泼, 可经由各种与含氧官能团的反应而改善本身性质[2]。氧化石墨烯可视为一种非传统型态的软性材料, 具有聚合物、胶体、薄膜以及两性分子的特性。氧化石墨烯长久以来被视为亲水性物质, 因为其在水中具有优越的分散性, 但是, 氧化石墨烯具有两亲性, 从石墨烯薄片边缘到中央呈现亲水至疏水的性质分布[3]。因此, 氧化石墨烯可如同界面活性剂一般存在界面, 并降低界面间的能量, 成为性能优异的新型碳纳米材料。氧化石墨烯复合材料包括聚合物类复合材料以及无机物类复合材料, 且都具有广泛的应用领域。GO还具有良好的水溶液稳定性, 对中药中难溶性的活性成分以及化学合成药物在发挥药效上起到至关重要的作用[4]。GO已在生物传感、成像、癌症治疗和药物输送、抗菌、疫苗增强剂等领域成为研究热点。
1、 结构及合成工艺
GO是石墨烯的氧化物, 其颜色为棕黄色, 市面上常见的产品有粉末状、片状以及溶液状的。氧化石墨烯的精确结构还无法得到确定。大家普遍接受的结构模型是在氧化石墨烯单片上随机分布着羟基和环氧基, 而在单片的边缘则引入了羧基和羰基[5]。氧化石墨烯一般由石墨经强酸氧化而得[6], 主要有3种制备方法:Brodie法、Staudenmaier法和Hummers法[7]。其中Hummers法的制备过程的时效性相对较好而且制备过程中也比较安全, 是目前最常用的一种。它采用浓硫酸中的高锰酸钾与石墨粉末经氧化反应之后, 得到棕色的在边缘有衍生羧酸基及在平面上主要为酚羟基和环氧基团的石墨薄片, 此石墨薄片层可以经超声或高剪切剧烈搅拌剥离为氧化石墨烯, 并在水中形成稳定、浅棕色的单层氧化石墨烯悬浮液[8]。由于共轭网络受到严重的官能化, 氧化石墨烯薄片具有绝缘的特质。经还原处理可进行部分还原, 得到化学修饰的石墨烯薄片。虽然最后得到的石墨烯产物或还原氧化石墨烯都具有较多的缺陷, 导致其导电性不如原始的石墨烯, 不过这个氧化—剥离—还原的制程可有效地让不可溶的石墨粉末在水中变得可加工, 提供制作还原氧化石墨烯的途径[9]。上述工艺已成为制造石墨烯相关材料及组件的极具吸引力的工艺过程。GO结构式如图1所示。
图1 GO结构式[5]Fig 1 Graphene oxide structure[5]
![图1 GO结构式[5]Fig 1 Graphene oxide structure[5]](http://www.xueshut.com/uploads/allimg/180906/36-1PZ616293Y61.jpg)
2、 氧化石墨烯作为药物、基因递送载体材料的研究
近几年来, 氧化石墨烯纳米材料在药物装载、基因传递等生物医学领域的应用发展迅速, 由于它的高表面积以及独特的物理化学性质使其具有较高装载能力, 还可在药物控释体统方面发挥重要作用。
2.1、 肿瘤药物递送载体
Farahnaz Barahuie等[10]利用改进的Hummers技术, 用石墨烯合成氧化石墨烯, 并结合抗癌药物绿原酸 (CA) 合成了绿原酸-氧化石墨烯纳米复合材料GO-CA。通过对复合材料进行表征, 发现绿原酸成功结合在氧化石墨烯上, 由拉曼光谱、红外光谱分析和X射线衍射图分析证实, GO和CA通过氢键和π-π键的相互作用成功结合。由紫外可见光谱发现复合物释放曲线表现良好, 并呈现持续的pH依赖性, 此外, 所合成的抗癌纳米复合物比对照组药物更稳定。体外细胞毒性结果显示, 当GO-CA纳米复合材料浓度达到50μg/mL甚至更高浓度时, 对正常细胞无明显的细胞毒性, 正常细胞存活率可达到80%, 反之, 复合物对肿瘤细胞系, 如人肝细胞肝癌细胞系、A549人肺腺癌上皮细胞、与人宫颈癌细胞系等显示出较强的毒性作用。Ghasem Rezanejade Bardajee等[11]在氧化石墨烯支链上结合了N-异丙基丙烯酰胺 (NIPAM) 和丙烯酸 (AA) , 合成了一种新型纳米凝胶NGs, 将强力霉素 (DOX) 负载到NGs上, 负载后的药物显示出了温度依赖性, NGs在中性和较低温度下缓慢释放药物, 在酸性pH值和较高温度下显着增加, 且无任何突发释放, 其他相关研究也表明GO装载药物表现出良好的生物靶向作用。
2.2、 化学合成药物的负载
另外, GO在也可对化学合成药物进行负载。方加龙等[12]通过氢键相互作用与π-π键堆积将肿瘤治疗首选抗代谢药氟尿嘧啶 (5-Fu) 负载到了β-环糊精 (β-CD) 和功能化的氧化石墨烯上, 形成β-CD-GO-5-Fu, 并通过标准曲线计算其负载率高达105%。β-CD表面有众多反应性羟基, 并作为一种碳水化合物可参与机体内代谢, 避免了药物的体内聚积, 同时还可以改善药物的稳定性, 降低5-Fu对胃肠道的刺激性, 减少不良反应的发生。杨琳等[13]通过动物实验对比GO负载5-Fu和5-Fu本身杀死肿瘤细胞的效率, 发现含等量药物的GO-5-Fu杀死乳腺癌4T1细胞的能力远比5-Fu本身高, 因此GO负载药物后可提高药物的疗效。
2.3、 传统中药的负载
GO在对传统中药的负载方面也有研究。徐远志等[14]用PEG-GO装载贝壳杉烷二帖类化合物毛萼乙素 (eriocalyxin B) , PEG-GO负载毛萼乙素后从而改善其亲水性和在盐溶液中的稳定性。通过预先制备的标准曲线计算得到PEG-GO对毛萼乙素的载药率达18.8%。将质量浓度为100mg/L的PEG-GO作用于A549细胞48h后, 细胞相对存活率依旧可达到85%以上, 说明PEG-GO细胞毒性较低。选择毛萼乙素本身和经PEG-GO负载的毛萼乙素分别对肺癌细胞A549细胞进行细胞毒性试验, 给药48h后, 原药组细胞存活率为28.5%, 而经PEG-GO负载的毛萼乙素组的细胞存活率仅为21.8%, 说明负载后的药物对A549细胞有更大的杀伤力。仇云兵等[15]将连翘中的重要单体金丝桃素负载到GO上, 所制得的复合物具有极高的稳定性并可提高金丝桃素的光敏性和吸附量, GO及GO衍生物对其他药物的装载也有研究 (表1) 。
表1 GO在药物传递中的应用Table 1The application of GO in drug delivery

2.4、 基因递送载体
直接基因转移可用于治疗人类疾病和遗传疾病, 该治疗方法需要一个载体来保护DNA免受核酸酶降解。聚乙烯亚胺 (PEI) 是目前应用最多的纳米载体材料。然而, PEI的生物相容性较差并有严重的细胞毒性, 与纯PEI相比, GO-PEI在最佳质量比下表现出较低的细胞毒性和较高的转染效率, 可以作为理想的基因载体[22]。
小的靶向生物分子通常很小, 很容易在体内很短时间内被消化。因此, 将载体分子安全地运送到所需的靶点是至关重要的, 而氧化石墨烯被认为是一个很好的选择[23]。有报道称, 在生物分子原位特异性检测中GO能有效提供分子信标 (MBS) 和适体进入细胞。以前的研究也表明, 单链DNA (ssDNA) 和RNA可以通过非共价吸附、叠加、静电和其他分子间的相互作用来固定在氧化石墨烯上, 这表明氧化石墨烯可作为潜在的基因载体。有研究表明氧化石墨烯能够保护核酸不被酶切并能够运送ssDNA进入细胞[24]。Li等[25]开发了一种GO纳米化的图案化底物, 以底物介导的方式在多个细胞系中建立了具有可定位的、有序的基因递送系统。该递送系统以GO基底作为DNA预浓缩的平台, 并可保持长时间的逐步释放。可PEI接枝的GO纳米载体也应用于递送siRNA和化学药品[26]。
2.5、 药物控释
为了能够在需要的最佳剂量和时间情况下递送药物, 一些新药物载体的方法已被开发出来, 它们能对内部 (机体的温度, pH值, 特定的化学反应) 或外部 (应用超声波、磁场和电场) 引发的刺激作出反应, 最近报道了几种基于GO对环境刺激敏感的药物传递系统[27]。当药物附着在药物载体上, 经过与pH敏感的连接器, 可以通过操纵环境pH值来控制药物的释放。这种简单的方法可以有效地避免药物在转运过程中不需要的药物释放, 并提高药物的在靶器官部位的有效释放。众多研究人员利用氧化石墨烯衍生物设计了许多更为复杂的pH敏感性药物载体[28]。Liu等[29]设计了单层磷脂膜功能化的氧化石墨烯, 所制备的纳米复合物呈现pH控制药物释放行为, 并具有70%的载药量。利用物理方法如电磁场和超声刺激纳米粒子药物释放, 这一概念也成功地应用到氧化石墨烯药物载体上。他们提出了一种制备GO/Fe3O4复合材料的简便方法, 通过外加磁场可以很容易地控制药物的释放, 其载药量可达200%[30]。这意味着药物释放行为和释放数量可在给药后得到控制。
3、 作为免疫增强剂
纳米级材料的化学成分、物理特性、生化修饰等都决定了其作为生物材料具有较为广阔的应用前景。此外, 已有研究证明免疫器官是纳米颗粒在全身分布的主要部位。以GO为基础的纳米材料可以调节免疫细胞在培养过程中的功能, 并诱导小鼠肺部炎症。近年来一些研究表明GO显示出了较强的免疫增强效果。因此, GO与免疫系统之间的相互作用受到广泛关注。
粒子是基于肽的纳米材料的另一种形式。使用基于肽的纳米粒子来优化疫苗效力的策略可分为两大类:第1类是利用基于肽的纳米粒子作为显示抗原抗原表位的平台[31]。 (图2 (a) 在此称之为抗原呈递粒子 (APNPs) 。 (图2 (b) ) 第2类是抗原本身组装为纳米粒子 (AANPs) 。
图2 抗原结合纳米粒作为抗原呈递平台[31]Fig 2Antigens combined with nanoparticles which are used as the platform for presenting antigen[31]
![图2 抗原结合纳米粒作为抗原呈递平台[31]Fig 2Antigens combined with nanoparticles which are used as the platform for presenting antigen[31]](http://www.xueshut.com/uploads/allimg/180906/36-1PZ61632112R.jpg)
Hsin-Ying Wu等[32]在白蛋白致敏前一小时给BALB/c小鼠静脉注射单剂量的PEG-GO (0.5或1mg/kg) , 7d后测定反应性抗原特异性抗体的产生和脾细胞的反应性, 结果显示PEG-GO显着降低血清OVA特异性免疫球蛋白E水平, 经过OVA致敏经PEG-GO处理后的脾细胞, 所产生的γ干扰素和白细胞介素-4水平与对照组相比明显增高, 这些结果表明PEG-GO在抗原特异性免疫反应的免疫调节作用中具有较大的潜能。Yu Tao等[33]采用聚乙二醇 (PEG) 和聚乙烯亚胺 (PEI) 双官能化GO聚合物 (GO-PEG-PEI) 作为高效的磷酸鸟嘌呤胞嘧啶 (CpG) 缓释载体。GO-PEG-PEI能明显促进炎性细胞因子的生产并增强CpG免疫刺激作用。体内实验表明在激光治疗肿瘤的过程中, GO-PEG-PEI-CpG复合物具有协同光热和免疫效应, 其对肿瘤的抑制率最高。
但是, 在GO在作为免疫增强剂时, 机体将会产生氧化应激和炎症反应等副作用。因此, 有必要开发出副作用较少的基于氧化石墨烯衍生物的免疫佐剂。Chunchun Meng等[34]应用具有较高安全性能的抗氧化剂—肌肽 (carnosine car) 结合氧化石墨烯形成GO-car复合物, 并将其作为免疫佐剂与卵清蛋白 (OVA) 共混合, 探究其在模型小鼠中的免疫特性, 结果显示, OVA@GO-car能够促进特异性抗体反应, 增强淋巴细胞增殖效率, 并提高CD4+T和CD8+T细胞的活化。GO-car的存在也可能有助于通过调节某些细胞因子的表达来增强抗原特异性的适应性免疫反应。此外, 经过肌肽改性后的GO, 对肺, 肌肉, 肾脏, 脾脏的组织学损伤明显减弱, 此研究表明GO-car作为一种安全免疫佐剂, 可以有效增强机体对抗原的体液及先天免疫反应。
4、 光动力治疗及生物成像
光动力疗法 (photodynamic therapy, PDT) 是成为肿瘤治疗的一项常规手段。截至目前, 这一疗法已成功地用于治疗多项恶性肿瘤[35]。PDT的治疗基础是光动力作用, 它需要具备3个基本要素:光敏剂、激发光与分子氧。PDT治疗肿瘤的基本原理是系统或局部给予的光敏剂在各组织中的半衰期不同, 一段时间后肿瘤组织中光敏剂浓度明显高于正常组织, 形成光敏剂在肿瘤组织的选择性滞留, 在特定波长激发光的作用下, 同时在分子氧存在的情况下, 产生单线态氧 (singlet oxygen) 及其它活性氧类物质 (reactive oxygenspecies, ROS) , 导致肿瘤细胞坏死和凋亡[36]。金属和磁性纳米粒子是过去应用于光热治疗中最多的材料, 由于GO具有独特的光热效应, 可在较低的光照条件下起到消除肿瘤的作用, 因此GO在光动力疗法上具有广阔的应用前景, 田博等[37]用聚乙二醇修饰的氧化石墨烯装载光敏剂分子Ce6, 形成的GO-PEG-Ce6复合物在光照下可产生单线态氧, 其复合物对癌细胞的破坏力较之单纯的Ce6增强。
目前已有许多功能化GO作为细胞成像和荧光发光的工具[38]。氧化石墨烯相关材料已在活体动物多个器官的生物成像中也有所应用 (图3) [39]。Sreejith S等[40]研发了一种由有机染料杂化材料, 介孔二氧化硅纳米颗粒 (MSNPs) , 并合成氧化石墨烯, 即将方酸菁染料装在MSNPs, MSNP表面再包裹超薄的GO, 在Hela细胞上证实该复合物具有较好的荧光成像功能, 具有较好的生物相容性且无细胞毒性。
5、 作为抗菌材料的研究
氧化石墨烯在抗菌领域也有众多研究和应用。Hu等[41]研究发现GO和还原氧化石墨烯纳米片 (rGO) 的水分散液能够有效的抑制大肠杆菌的生长, 且细胞毒性小。此后众多研究发现GO对多种常见的细菌均可产生抑制作用[42]。GO作为一种新型绿色广谱抗菌材料, 对细菌的耐药性和耐受性很强。它通过物理损伤, 如尖锐边缘与细菌膜的直接接触、包裹、光热消融机制以及破坏性提取脂质分子等方式来发挥抗菌作用[43] (图4) 。近年来, 用不同类型的金属纳米粒子修饰GO, 也显示出潜在的抗菌活性[44-46]。Tang[47]等制备了GO-Ag纳米复合材料, 并研究其对革兰阴性菌 (大肠杆菌) 和革兰氏阳性菌 (金黄色葡萄球菌) 的抗菌活性。据观察, 相比AgNPs, GO-Ag纳米复合物 (在最优比例下) 更有效, 表现出协同增强的抗菌作用, 且在较低剂量下仍具有较强抗菌活性。
图3 氧化石墨烯相关材料在活体动物生物成像中的可能应用Fig 3 Graphene and graphene-related materials used as probes for whole-body functional in vivo bio-imaging of live animals
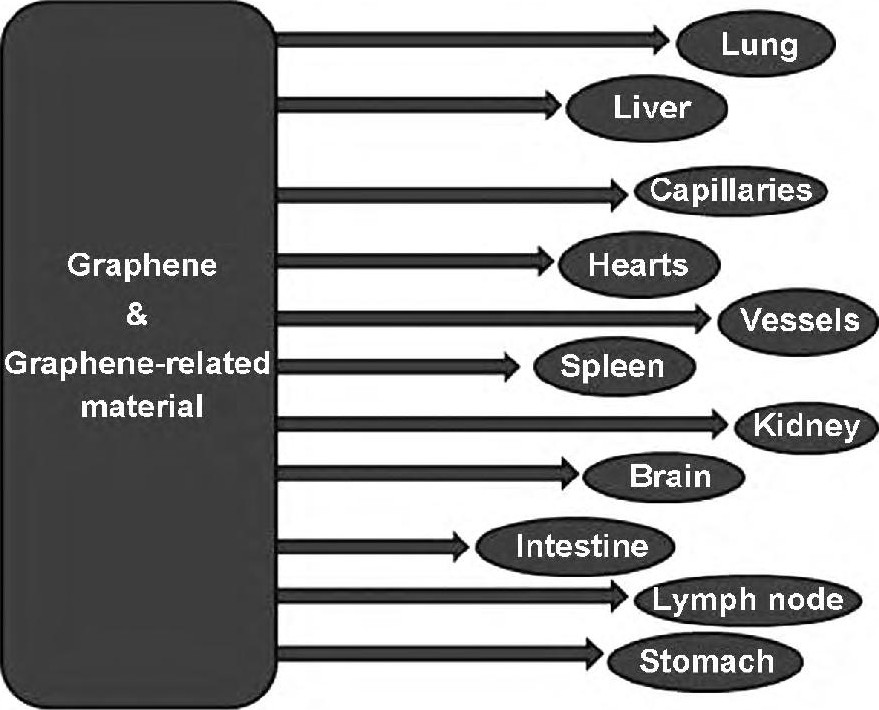
图4 纳米材料的各种抗菌机制[48]Fig 4Various antimicrobial mechanisms provided by nanomaterials[48]
![图4 纳米材料的各种抗菌机制[48]Fig 4Various antimicrobial mechanisms provided by nanomaterials[48]](http://www.xueshut.com/uploads/allimg/180906/36-1PZ6163314U8.jpg)
6、 其它最新应用
阿尔茨海默氏病 (AD) 是社会上最严重的公共卫生危机之一, 由于目前还没有治愈AD的方法, 早期诊断AD的生物标志物对治疗至关重要。Demeritte等[49]设计了以磁核壳纳米粒子连接的混合等离子体GO为基础的多功能平台, 可从全血中高选择性分离AD的生物标志物, 紧接着表面增强拉曼光谱 (SERS) 可在毫微克水平对无标记的AD生物标志物进行鉴定。实验数据表明, ELISA抗体平台有能力捕获超过98%的AD生物标志物的血液样本。这种极高的灵敏度可能是由于强烈的等离子体激元耦合, 在“热点”上产生了巨大的放大电磁场。具体方法如图5所示。骨或“天然复合材料”具有优越的能量耗散和抗断裂能力。然而, 很少有方法用碳纳米材料模拟该理想结构。Oh等[50]制造了基于氧化石墨烯物和碳纳米管 (CNT) 复合物, 该复合物可以模拟自然骨结构。将较小的GO薄片均匀掺入碳纳米管中。所得薄膜具有很高的拉伸强度、韧性和导电性。另外, GO独特的表面性质可以作为调节细胞行为和各种生物序列的重要工具。GO也在生物医学其它领域有了最新的应用[51-53]。
图5 核壳纳米粒子连接的混合氧化石墨烯复合功能平台发展的合成途径 (a) 和无标记的SERS检测AD的生物标志物等离子体磁混合氧化石墨烯的平台 (b) [49]Fig 5 The synthetic pathway for the development of core-shell nanoparticle attached hybrid graphene oxide based multifunctonal nanoplatform (a) and plasmonic-magnetic hybrid graphene oxide platform for label-free SERS detection of AD biomarkers (b) [49]
图5 核壳纳米粒子连接的混合氧化石墨烯复合功能平台发展的合成途径 (a) 和无标记的SERS检测AD的生物标志物等离子体磁混合氧化石墨烯的平台 (b) [49]Fig 5 The synthetic pathway for the development of core-shell
![图5 核壳纳米粒子连接的混合氧化石墨烯复合功能平台发展的合成途径 (a) 和无标记的SERS检测AD的生物标志物等离子体磁混合氧化石墨烯的平台 (b) [49]Fig 5 The synthetic pathway for the development of core-shell](http://www.xueshut.com/uploads/allimg/180906/36-1PZ6163422633.jpg)
7、 生物安全性
随着氧化石墨烯的广泛应用, 关于氧化石墨烯材料的生物安全性逐渐引起了人们的关注。目前, 研究人员已在细胞及实验动物体内进行了GO的毒性研究。GO可破坏细胞结构, 例如, GO能够以剂量、形状依赖性破坏PC12细胞线粒体, 同时以剂量、时间依赖性破坏Hep G2细胞的细胞膜完整性[54]。
评估GO的体内毒性是生物医学应用之前必不可少的。然而, 研究表明, 在某些器官, 如肺和肝脏, GO会导致潜在的毒性。Wang等[55]用小鼠进行生物相容性研究, 其中静脉注射低剂量 (0.1mg) 和中剂量 (0.25mg) 的小鼠没有发现毒性, 而高剂量的GO (0.4mg) 导致慢性毒性。另一项研究表明, GO大小不同所蓄积部位也有所差异, 较大的GO粒子如1~5μm和110~500nm积聚在肺部, 而较小的颗粒积聚在肝脏[56]。另一方面, 有研究发现GO在20mg/kg的剂量下最初积累在肝、脾等组织, 后期又被清除直至无毒[57]。GO诱导线粒体产生活性氧 (ROS) , 激活炎症和凋亡通路, 并导致严重的持续性肺损伤, 而聚集的氧化石墨烯和分散的石墨烯处理的小鼠没有明显的肺损伤[58]。日本大耳白兔玻璃体内注射0.1, 0.2或0.3 mg浓度的GO, 对眼部没有造成临床病变, 对眼压和视力在治疗动物中的影响可忽略不计[59]。一项研究中, 小鼠静脉注射剂量为20 mg/kg的聚乙二醇-纳米氧化石墨烯 (NGO-PEG) 时, NGO-PEG处理组与对照组相比在不同时间中没有发现明显的器官损伤或炎症反应[60]。低浓度的GO对细胞摄取、形态、存活率、死亡率和膜完整性等无显着影响[61]。在不同的细胞系中, 与其它细胞系相比, GO对HeLa细胞表现出更大的毒性[62]。表2描述了GO在不同动物模型体内的毒性研究结果。
表2 GO在不同动物模型体内毒性研究结果Table 2In vivo study results of different model animals

8、 结语
综述了GO在生物医学等方面的研究现状。GO以独特的机械、电子、光学性质使其在生物技术、生物医学工程、纳米医学、肿瘤治疗、组织工程、药物释放、生物成像和生物分子传感等方面都发挥了巨大的作用。与其它球形或平面形纳米材料相比, GO比表面积大、强度高、易修改、并且具有良好的生物相容性。GO及其烯衍生物的尺寸、表面电荷、层数、横向尺寸和表面化学等参数都会对生物系统产生相应的影响, 因此GO的生物安全问题使其在临床应用上造成了一定的限制, 包括它们的细胞毒性、体内毒性, 遗传毒性及在某些器官 (如肺和肝脏) 中的生物蓄积性都有待进一步研究。随着材料科学的发展, 我们必将运用毒性低、生物相容性更好的材料来修饰GO, 从而制备出性质稳定、结构明确、安全无毒的GO, 使其作为安全有效的医用材料进入更为广阔的临床研究之中。
参考文献:
[1]Barahuie F, Saifullah B, Dorniani D, et al.Corrigendum to“graphene oxide as a nanocarrier for controlled release and targeted delivery of an anticancer active agent, chlorogenic acid”[J].Mater Sci Eng C Mater Biol Appl, 2017, 74:177-185.
[2]Bastos G, Patino-Barbeito F, Patino-Cambeiro F, et al.Nano-inclusions applied in cement-matrix composites:a review[J].Materials (Basel) , 2016, 9 (12) :1015.
[3]Zhu Hongwen, Duan Zhengkang, Zhang Lei, et al.Review on preparation and structure of graphene oxide[J].Materials Science&Thchnology, 2017, 25 (06) :82-88 (in Chinese) .朱宏文, 段正康, 张蕾, 等.氧化石墨烯的制备及结构研究进展[J].材料科学与工艺, 2017, 25 (06) :82-88
[4]Zhao Z, Sun Y, Dong F.Graphitic carbon nitride based nanocomposites:a review[J].Nanoscale, 2015, 7 (1) :15-37.
[5]Zhou Z M, Feng Z, Zhou J, et al.Capillary electrophoresis-chemiluminescence detection for carcino-embryonic antigen based on aptamer/graphene oxide structure[J].Biosens Bioelectron, 2015 (64) :493-498.
[6]Karikalan N, Karthik R, Chen S M, et al.Sonochemical synthesis of sulfur doped reduced graphene oxide supported CuS nanoparticles for the non-enzymatic glucose sensor applications[J].Sci Rep, 2017, 7 (1) :2494.
[7]Zhu Y, Murali S, Cai W, et al.Graphene and graphene oxide:synthesis, properties, and applications[J].Adv Mater, 2010, 22 (35) :3906-3924.
[8]Yu H, Zhang B, Bulin C, et al.High-efficient synthesis of graphene oxide based on improved hummers method[J].Sci Rep, 2016 (6) :36143.
[9]Soltani T, Lee B K.Low intensity-ultrasonic irradiation for highly efficient, eco-friendly and fast synthesis of graphene oxide[J].Ultrason Sonochem, 2017 (38) :693-703.
[10]Dorniani D, Saifullah B, Barahuie F, et al.Graphene oxide-gallic acid nanodelivery system for cancer therapy[J].Nanoscale Res Lett, 2016, 11 (1) :491.
[11]Bardjee G R, Hooshyar Z, Farsi M, et al.Synthesis of a novel thermo/pH sensitive nanogel based on salep modified graphene oxide for drug release[J].Mater Sci Eng C Mater Biol Appl, 2017 (72) :558-565.
[12]Fang Jialong, Xu Jun, Zhang Yanwen, et al.Preparation and in vitro release of functionalized graphene oxide loading fluorouracil[J].Chin J Mod Appl Pharm, 2014 (10) :1215-1219 (in Chinese) .方加龙, 许军, 张雁雯, 等.功能化氧化石墨烯负载氟尿嘧啶制备及体外释放研究[J].中国现代应用药学, 2014 (10) :1215-1219.
[13]邓佳, 赵耀林, 贺朝会, 等.Co (Ⅱ) 在磁性氧化石墨烯/壳聚糖复合材料上的吸附行为研究:中国化学会第30届学术年会[C].大连, 2016.
[14]Xu Zhiyuana, Li Yongjun, Shi Ping, et al.Functionalized graphene oxide as a nanocarrier for loading and delivering of eriocalyxin B[J].Chinese Journal of Organic Chemistry, 2013 (10) :2162-2168 (in Chinese) .徐志远, 李永军, 史萍, 等.功能化石墨烯负载毛萼乙素抗肿瘤制剂的研究[J].有机化学, 2013 (10) :2162-2168.
[15]Qiu Yunbing, Wang Xinghe, Zhou Yanhuai.Study on preparation and application of graphene/kinesin nanocomposites[J].Journal of NanJing Normal University (Natural Science Edition) , 2016 (04) :146-148 (in Chinese) .仇云兵, 王兴和, 周延怀.石墨烯/金丝桃素纳米复合材料的制备及其应用研究[J].南京师大学报 (自然科学版) , 2016 (04) :146-148.
[16]Gu Y, Guo Y, Wang C, et al.A polyamidoamne dendrimer functionalized graphene oxide for DOX and MMP-9shRNA plasmid co-delivery[J].Mater Sci Eng C Mater Biol Appl, 2017, 70 (1) :572-585.
[17]Bai H, Li C, Wang X, et al.A pH-sensitive graphene oxide composite hydrogel[J].Chem Commun (Camb) , 2010, 46 (14) :2376-2378.
[18]Lu Y J, Yang H W, Hung S C, et al.Improving thermal stability and efficacy of BCNU in treating glioma cells using PAA-functionalized graphene oxide[J].Int J Nanomedicine, 2012 (7) :1737-1747.
[19]Servant A, Leon V, Jasim D, et al.Graphene-based electroresponsive scaffolds as polymeric implants for ondemand drug delivery[J].Adv Healthc Mater, 2014, 3 (8) :1334-1343.
[20]Zhang L, Xia J, Zhao Q, et al.Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs[J].Small, 2010, 6 (4) :537-544.
[21]Zhi F, Dong H, Jia X, et al.Functionalized graphene oxide mediated adriamycin delivery and miR-21gene silencing to overcome tumor multidrug resistance in vitro[J].PLoS One, 2013, 8 (3) :e60034.
[22]Kim H, Lee D, Kim J, et al.Photothermally triggered cytosolic drug delivery via endosome disruption using a functionalized reduced graphene oxide[J].ACS Nano, 2013, 7 (8) :6735-6746.
[23]Wang Y, Li Z, Wang J, et al.Graphene and graphene oxide:biofunctionalization and applications in biotechnology[J].Trends Biotechnol, 2011, 29 (5) :205-212.
[24]Wu S Y, An S S, Hulme J.Current applications of graphene oxide in nanomedicine[J].Int J Nanomedicine, 2015, (10) :9-24.
[25]Li K, Feng L, Shen J, et al.Patterned substrates of nano-graphene oxide mediating highly localized and efficient gene delivery[J].ACS Appl Mater Interfaces, 2014, 6 (8) :5900-5907.
[26]Rao Z, Ge H, Liu L, et al.Carboxymethyl cellulose modified graphene oxide as pH-sensitive drug delivery system[J].Int J Biol Macromol, 2018 (107) :1184-1192.
[27]Liu Z, Robinson J T, Sun X, et al.PEGylated nanographene oxide for delivery of water-insoluble cancer drugs[J].J Am Chem Soc, 2008, 130 (33) :10876-10877.
[28]Chen W, Yi P, Zhang Y, et al.Composites of aminodextran-coated Fe3O4 nanoparticles and graphene oxide for cellular magnetic resonance imaging[J].ACS Appl Mater Interfaces, 2011, 3 (10) :4085-4091.
[29]Liu Y, Xu Y, Tian Y, et al.Functional nanomaterials can optimize the efficacy of vaccines[J].Small, 2014, 10 (22) :4505-4520.
[30]Wu H Y, Lin K J, Wang P Y, et al.Polyethylene glycol-coated graphene oxide attenuates antigen-specific IgE production and enhanced antigen-induced T-cell reactivity in ovalbumin-sensitized BALB/c mice[J].Int J Nanomedicine, 2014 (9) :4257-4266.
[31]Tao Y, Auguste D T.Array-based identification of triple-negative breast cancer cells using fluorescent nanodot-graphene oxide complexes[J].Biosens Bioelectron, 2016 (81) :431-437.
[32]Meng C, Zhi X, Li C, et al.Graphene oxides decorated with carnosine as an adjuvant to modulate innate immune and improve adaptive immunity in vivo[J].ACS Nano, 2016, 10 (2) :2203-2213.
[33]Hosseinzadeh R, Khorsandi K, Hosseinzadeh G.Graphene oxide-methylene blue nanocomposite in photodynamic therapy of human breast cancer[J].J Biomol Struct Dyn, 2017 (4) :1-8.
[34]He Y, Del V A, Qian Y, et al.Near infrared light-mediated enhancement of reactive oxygen species generation through electron transfer from graphene oxide to iron hydroxide/oxide[J].Nanoscale, 2017, 9 (4) :1559-1566.
[35]Gollavelli G, Ling Y C.Multi-functional graphene as an in vitro and in vivo imaging probe[J].Biomaterials, 2012, 33 (8) :2532-2545.
[36]Kumar S, Chatterjee K.Comprehensive review on the use of graphene-based substrates for regenerative medicine and biomedical devices[J].ACS Appl Mater Interfaces, 2016, 8 (40) :26431–26457
[37]田博.基于氧化石墨烯纳米载体的光热增强的光动力学癌症治疗[D].苏州:苏州大学, 2012.
[38]Sreejith S, Ma X, Zhao Y.Graphene oxide wrapping on squaraine-loaded mesoporous silica nanoparticles for bioimaging[J].J Am Chem Soc, 2012, 134 (42) :17346-17349.
[39]Guo J, Han S N, Liu J X, et al.The action of a novel fluoroquinolone antibiotic agent antofloxacin hydrochloride on human-ether-a-go-go-related gene potassium channel[J].Basic Clin Pharmacol Toxicol, 2010, 107 (2) :643-649
[40]Gurunathan S.Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosa[J].Int J Nanomedicine, 2012 (7) :5901-5914.
[41]Ristic B Z, Milenkovic M M, Dakic I R, et al.Photodynamic antibacterial effect of graphene quantum dots.Biomaterials, 2014.35 (15) :4428-35.
[42]Gholibegloo E, Karbasi A, Pourhajibagher M, et al.Carnosine-graphene oxide conjugates decorated with hydroxyapatite as promising nanocarrier for ICG loading with enhanced antibacterial effects in photodynamic therapy against Streptococcus mutans[J].J Photochem Photobiol B, 2018 (181) :14-22.
[43]Fathalipour S, Pourbeyram S, Sharafian A, et al.Biomolecule-assisted synthesis of Ag/reduced graphene oxide nanocomposite with excellent electrocatalytic and antibacterial performance[J].Mater Sci Eng C Mater Biol Appl, 2017 (75) :742-751.
[44]Tang J, Chen Q, Xu L, et al.Graphene oxide-silver nanocomposite as a highly effective antibacterial agent with species-specific mechanisms[J].ACS Appl Mater Interfaces, 2013, 5 (9) :3867-3874.
[45]Yousefi M, Dadashpour M, Hejazi M, et al.Anti-bacterial activity of graphene oxide as a new weapon nanomaterial to combat multidrug-resistance bacteria[J].Mater Sci Eng C Mater Biol Appl, 2017 (74) :568-581.
[46]Lammel T, Boisseaux P, Fernandez-Cruz M L, et al.Internalization and cytotoxicity of graphene oxide and carboxyl graphene nanoplatelets in the human hepatocellular carcinoma cell line Hep G2[J].Part Fibre Toxicol, 2013 (10) :27-32.
[47]Akhavan O, Ghaderi E, Akhavan A.Size-dependent genotoxicity of graphene nanoplatelets in human stem cells[J].Biomaterials, 2012, 33 (32) :8017-8025.、
[48]Demeritte T, Nellore B P, Kanchanapally R, et al.Hybrid graphene oxide based plasmonic-magnetic multifunctional nanoplatform for selective separation and label-free identification of Alzheimer’s disease biomarkers[J].ACS Appl Mater Interfaces, 2015, 7 (24) :13693-13700.
[49]Oh J Y, Kim Y S, Jung Y, et al.Preparation and exceptional mechanical properties of bone-mimicking sizetuned graphene oxide@carbon nanotube hybrid paper[J].ACS Nano, 2016, 10 (2) :2184-2192.
[50]Zhang B, Wang Y, Zhai G.Biomedical applications of the graphene-based materials[J].Mater Sci Eng C Mater Biol Appl, 2016 (61) :953-964.
[51]Paz E, Forriol F, Del R J, et al.Graphene oxide versus graphene for optimisation of PMMA bone cement for orthopaedic applications[J].Mater Sci Eng C Mater Biol Appl, 2017 (77) :1003-1011.
[52]Zhang Q, Wu Z, Li N, et al.Advanced review of graphene-based nanomaterials in drug delivery systems:synthesis, modification, toxicity and application[J].Mater Sci Eng C Mater Biol Appl, 2017 (77) :1363-1375.
[53]Zhao Y, Zhi L, Wu Q, et al.p38 MAPK-SKN-1/Nrf signaling cascade is required for intestinal barrier against graphene oxide toxicity in Caenorhabditis elegans[J].Nanotoxicology, 2016, 10 (10) :1469-1479.
[54]Wang X, Podila R, Shannahan J H, et al.Intravenously delivered graphene nanosheets and multiwalled carbon nanotubes induce site-specific Th2inflammatory responses via the IL-33/ST2axis[J].Int J Nanomedicine, 2013 (8) :1733-1748.
[55]Yang K, Wan J, Zhang S, et al.In vivo pharmacokinetics, long-term biodistribution, and toxicology of PEGylated graphene in mice[J].ACS Nano, 2011, 5 (1) :516-522.
[56]Duch M C, Budinger G R, Liang Y T, et al.Minimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lung[J].Nano Lett, 2011, 11 (12) :5201-5207.
[57]Yan L, Wang Y, Xu X, et al.Can graphene oxide cause damage to eyesight[J].Chem Res Toxicol, 2012, 25 (6) :1265-1270.
[58]Yang K, Wan J, Zhang S, et al.The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J].Biomaterials, 2012, 33 (7) :2206-2214.
[59]Chang Y, Yang S T, Liu J H, et al.In vitro toxicity evaluation of graphene oxide on A549cells[J].Toxicol Lett, 2011, 200 (3) :201-210.
[60]Duch M C, Budinger G R, Liang Y T, et al.Minimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lung[J].Nano Lett, 2011, 11 (12) :5201-5207.
[61]Wen K P, Chen Y C, Chuang C H, et al.Accumulation and toxicity of intravenously-injected functionalized graphene oxide in mice[J].J Appl Toxicol, 2015, 35 (10) :1211-1218.
[62]Gollavelli G, Ling Y C.Multi-functional graphene as an in vitro and in vivo imaging probe.Biomaterials, 2012.33 (8) :2532-2545.
[63]Wu W, Yan L, Wu Q, et al.Evaluation of the toxicity of graphene oxide exposure to the eye[J].Nanotoxicology, 2016, 10 (9) :1329-1340.
[64]Mullick C S, Lalwani G, Zhang K, et al.Cell specific cytotoxicity and uptake of graphene nanoribbons[J].Biomaterials, 2013, 34 (1) :283-293.
[65]Wu W, Yan L, Wu Q, et al.Evaluation of the toxicity of graphene oxide exposure to the eye.Nanotoxicology, 2016.10 (9) :1329-1340.





