广东凉茶是岭南人民根据本地气候、水土特性,研制总结出的一类具有清热解毒、生津止渴等功效的植物饮料。癍痧凉茶是一种着名的广东凉茶,具有清热解毒、祛湿除癍、消暑散热、化痰止咳、开胃消滞等独特疗效,现市场上销售的癍痧凉茶有 “黄振龙”和 “平安堂”两种品牌。由于癍痧凉茶是采用多味中药熬制而成的复方制剂,成分复杂,涵盖了不同极性、多个种类的化合物,分析和鉴定其中的化学成分成为该产品质量控制以及阐明其作用机理的关键。
指纹图谱是评价中药和中药制剂整体质量的有效手段。中国和美国国家食品药品监督局、德国药用植物学会、英国草药典、印度草药典和加拿大药用及芳香植物学会等机构均将指纹图谱作为质量控制标准的内容之一。高效液相色谱( HPLC) 紫外检测( UV) /二极管阵列检测( DAD) 是目前最为成熟的指纹图谱分析方法。然而,中药含有很多无共轭体系的化合物,因其没有紫外吸收或紫外吸收很弱而在 HPLC - UV/DAD 指纹图谱上无法表现出来,从而造成指纹图谱信息的不完全。这一不足可以通过高效液相色谱 - 质谱联用( HPLC - MS) 得以克服。HPLC - MS 因具有比 HPLC - UV/DAD更好的化合物分析和鉴定能力而应用于中药分析研究,在中药指纹图谱分析方面更具优势。本文以“黄振龙”和 “平安堂”癍痧凉茶为研究对象,采用高效液相色谱 - 飞行时间质谱法( HPLC - TOF -MS) 和高效液相色谱 - 离子阱质谱法( HPLC - IT - MS) 对其所含化学成分进行分析,同时采用 HPLC -IT - MS 建立了癍痧凉茶的液质联用指纹图谱,并采用主成分分析对 41 批次的癍痧凉茶的质量稳定性和一致性进行了评价。
1 实验部分
1. 1 仪器与试剂
1200 高效液相色谱仪配备二元梯度泵、在线脱气机、自动进样器、柱温箱,TOF - MS 飞行时间质谱仪,Trap XCT 离子阱质谱仪,Poroshell 120 SB - C18快速分离型高效液相色谱柱( 150 mm ×2. 1 mm,2. 7 μm) 购于美国 Agilent 公司。甲醇、乙腈( 色谱纯,美国 Sigma 公司) ; 甲酸和乙醇( 分析纯,广州化学试剂厂) ; 实验用水为超纯水设备( 美国 Millipore 公司) 制备的超纯水。
对照品: 葡萄糖酸、奎宁酸、苹果酸、柠檬酸均购自美国 Sigma - Aldrich 公司; 没食子酸购自中国药品生物制品检定所; 绿原酸、新绿原酸、隐绿原酸、异绿原酸 A、异绿原酸 B、异绿原酸 C、木犀草苷、黄芩苷购自四川成都普思生物科技有限公司。所有对照品的纯度均大于 98%。21 批 “黄振龙” ( HZL) 癍痧凉茶样品和 20 批 “平安堂” ( PAT) 癍痧凉茶样品分别购自广州黄振龙凉茶连锁店和平安堂凉茶连锁店。
1. 2 对照品溶液的制备
准确称取对照品各 5. 0 mg 置于 50 mL 容量瓶中,用甲醇溶解并定容,作为单一对照品溶液。分别精密吸取各单一对照品溶液 2. 0 mL 至50 mL 容量瓶中,甲醇稀释定容,得到4 mg/L 混合对照品溶液。
1. 3 样品分析
“黄振龙”和 “平安堂”癍痧凉茶样品过 0. 45 μm 微孔滤膜后,分别采用 1200HPLC - MS TrapXCT 和 1200HPLC - TOF - MS 进行分析。色谱柱: Agilent Poroshell 120 SB - C18( 150 mm ×2. 1 mm,2. 7μm) ; 流动相 A 为 0. 5% 甲酸,B 为乙腈,梯度洗脱: 0 ~1 min,0% B,1 ~ 40 min,0 ~ 45% B; 40 ~60 min,45%~ 95% B; 后运行 10 min,0% B。流速 0. 3 mL / min; 进样量为 1. 0 μL,柱温为 35 ℃ 。
离子阱质谱分析: 电喷雾( ESI) 离子源,正、负离子扫描模式; 雾化气( N2) 压力 345 kPa,干燥气( N2) 流速10 L/min,干燥气温度350 ℃; 毛细管电压4 000 V。扫描质量范围 m/z 50 ~1 500。Auto MS3模式,自动寻找丰度最高的 3 个离子进行二级和三级质谱分析。
飞行时间质谱分析: ESI 离子源,负离子模式检测; 雾化气( N2) 压力 345 kPa,干燥气( N2) 流速10 L / min,干燥气温度 350 ℃ ; 毛细管电压 4 000 V,碎裂电压 100 V,锥孔电压 65 V; 扫描质量范围m / z 50 ~ 1 500,Profile 模式记录,高分辨测试参比离子 m / z 112. 9856、1 033. 988 1。
2 结果与讨论
2. 1 仪器条件的优化
2. 1. 1 色谱条件的优化 考察了不同比例的甲醇 - 水、乙腈 - 水、甲醇 - 0. 5% 甲酸水溶液和乙腈 -0. 5% 甲酸水溶液为流动相时各化合物的分离效果,结果发现有机相为乙腈时的洗脱效果优于甲醇,各色谱峰分离效果更为理想。而 0. 5%甲酸的加入可以有效改善有机酸成分色谱峰的拖尾现象,因此实验采用乙腈 -0. 5%甲酸水溶液作为流动相。
2. 1. 2 色谱柱的选择 比较了常规 5 μm 粒径的高效液相色谱柱和 2. 7 μm 粒径的快速分离色谱柱。
结果表明,常规色谱柱分析时间长、流动相消耗大; 快速分离色谱柱能够显着缩短分离时间,且具有更高的灵敏度及更好的分离度,在中药复杂组分的分离中更具优势。
2. 1. 3 色谱柱的优化 实验比较了正、负离子两种扫描模式下的色谱峰形,结果发现负离子模式下,色谱峰较多且质谱响应较好,故选择负离子模式扫描。另外还对其他质谱参数( 如毛细管电压、碎裂电压、锥孔电压、干燥气温度、干燥气流速、雾化气压力) 进行了优化,得到最佳的质谱条件为: 负离子模式扫描,雾化气( N2) 压力 345 kPa,干燥气( N2) 流速 10 L/min,干燥气温度 350 ℃; 毛细管电压4 000 V,碎裂电压 100 V,锥孔电压 65 V。
2. 2 癍痧凉茶化学成分鉴定在负离子模式下,大部分化合物检测得到[M - H]-的准分子离子峰。通过分析 HPLC - MS 色谱图中每个化合物的 TOF - MS 高分辨质谱的精确分子量信息,可以推测出化合物可能的分子式; 根据 IT -MS 的多级质谱碎片的信息则能够推测出化合物可能的结构信息。
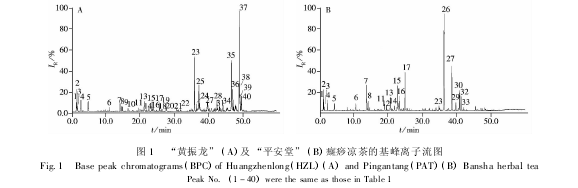
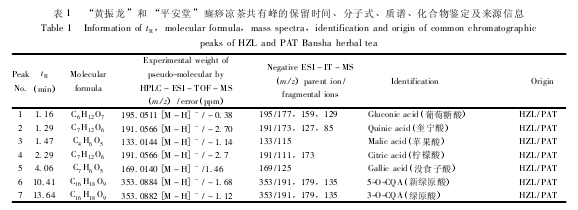
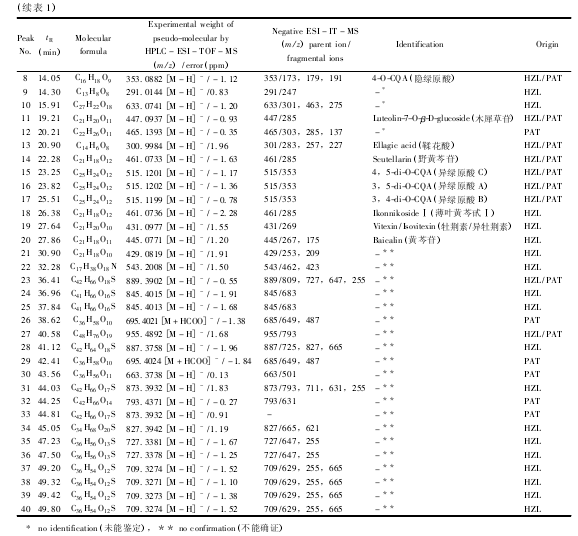
“黄振龙”和 “平安堂”两种癍痧凉茶总共含有 40 个主要化学成分( 图 1A 和 B 分别为 “黄振龙”及 “平安堂”癍痧凉茶的基峰离子流图) ,图中1 ~40 号峰为两种癍痧凉茶的化学成分鉴定情况。通过与对照品比较保留时间、准分子离子峰和多级质谱碎片信息,13 个化合物得到了确证,其中 1 号峰为葡萄糖酸,2 号峰为奎尼酸,3 号峰为苹果酸,4 号峰为柠檬酸,5 号峰为没食子酸,6 号峰为新绿原酸,7 号峰为绿原酸,8 号峰为隐绿原酸,11 号峰为木犀草苷,15 号峰为异绿原酸 C,16 号峰为异绿原酸 A,17 号峰为异绿原酸 B,20 号峰为黄芩苷,化合物13、14、18、19 号峰推测可能为鞣花酸、野黄芩苷、薄叶黄芩甙Ⅰ、牡荆素/异牡荆素。化合物 9、10、12 号峰因缺乏对照品未能鉴定,化合物21 ~ 40 号峰具有较大的峰面积,显示失去葡萄糖[M - 162]-的信号,从质谱信息推断可能为三萜皂苷类化合物,由于缺乏对照品不能得到确证。表 1 给出了 “黄振龙”和 “平安堂”癍痧凉茶中的 40 个共有峰的保留时间、分子式以及 ESI - MSn产生的主要碎片离子。从化学成分分析的结果来看,“黄振龙”和 “平安堂”癍痧凉茶的主要化学成分为有机酸、黄酮类和三萜皂苷类成分,两种凉茶的有机酸和黄酮类成分很相似,但三萜皂苷类成分的差异较大,提示两种凉茶的配方组成和生产工艺存在一定差异。
2. 3 指纹图谱的建立
取 21 批次 “黄振龙”癍痧凉茶样品溶液和 20 批次 “平安堂”癍痧凉茶样品溶液,在优化实验条件下进行指纹图谱分析并记录质量色谱图。将每个样品的 BPC( Base peak chromatogram) 质量色谱图导出为 . csv 文件,作为每个样品的 HPLC - IT - MS 指纹图谱,用于统计学分析。
2. 4 指纹图谱方法学验证
2. 4. 1 系统适应性试验 取样品 HZL01 的供试品溶液,在优化条件下,连续进样 5 次,以绿原酸色谱峰为参照峰( S 峰) ,考察各共有峰的相对保留时间及相对峰面积的一致性。结果显示各共有峰相对保留时间的 RSD 值不大于 0. 79%,相对峰面积的 RSD 值不大于 3. 7%,表明仪器分析的精密度良好。
2. 4. 2 重复性试验 取同一批号样品( HZL01) 6 份,分别配成供试品溶液进行测定,以绿原酸色谱峰为参照峰( S 峰) ,考察各共有峰的相对保留时间及相对峰面积的重复性。结果显示各共有峰相对保留时间的 RSD 不大于 0. 40%,相对峰面积的 RSD 值不大于 4. 2%,表明该方法的重现性良好。
2. 4. 3 稳定性试验 取同一批号样品( HZL01) 的供试品溶液,分别在 0、3、6、9、12、24 h 进样,以绿原酸色谱峰为参照峰( S 峰) ,考察各共有峰的相对保留时间及相对峰面积的稳定性。结果显示各共有峰相对保留时间的 RSD 值不大于 0. 96%,相对峰面积的 RSD 值不大于 3. 7%,表明供试品溶液在24 h 内稳定。
2. 5 主成分分析
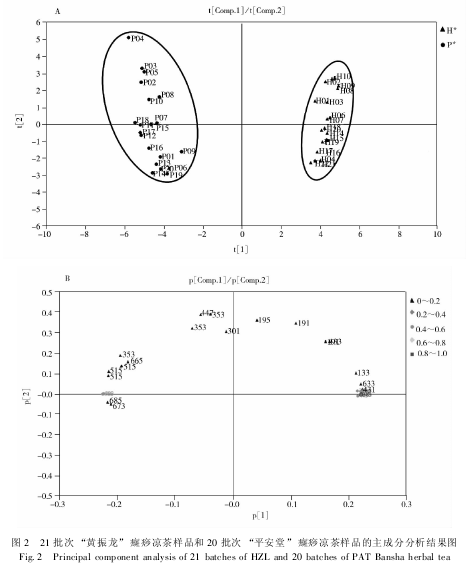
主成分分析是利用降维的思想,在损失很少信息的前提下把多个指标转化为几个综合指标的多元统计方法。本文以色谱峰的峰面积为变量,以 41 批癍痧凉茶为观察对象,采用 SIMCA - P11. 5 DEMO统计分析软件对 41 批次的癍痧凉茶样本进行主成分分析。主成分个数提取原则为主成分对应的特征值大于 1 的前 m 个主成分。从方差贡献率来看,λ1= 19. 3,贡献率为 68. 8% ,贡献率最大、包含的信息最多; λ2= 4. 51,贡献率为 16. 1% 。前 2 个主成分的累计贡献率即达 84. 9% ,对前 2 个主成分分析已经能反映癍痧凉茶的基本特征。分别以第一和第二主成分建立坐标系,进行投影即可得到所有样本的PCA 得分图和载荷图,得分图用来区分样本,载荷图则可以用来分析变量对样本分类所起的作用。
图 2A 为癍痧凉茶的二维 PCA 得分图。图中每个点代表一个样本,其中 H 代表黄振龙凉茶,P 代表平安堂凉茶。从图 2A 可看到两种癍痧凉茶得到良好的区分。其中黄振龙凉茶( H01 ~ H21) 和平安堂凉茶( P01 ~ P20) 能够明显的分为两类,代表这两种凉茶存在着差异。
图 2B 为癍痧凉茶的二维 PCA 载荷图。图中每个点代表一个色谱峰。色谱峰的系数绝对值在载荷图中得分越高,表明该峰对样品分类所起的作用越大。3 个主成分中,第一大主成分是特征值最大的,即 “信息最多”的指标,第一主成分中系数的绝对值越大,对样本分类所起的作用越大。从图 2B 能够看到 m/z 685、793、955、727、845、889 的峰系数的绝对值最大。结合图 2A 的二维主成分得分图分析,可以看出 m/z 685、793、955 这三个峰与第一主成分呈负相关,并且与 “平安堂”癍痧凉茶所在区域相对应,表明这三个峰对 “平安堂”癍痧凉茶的分类起着重要作用,m/z 727、845、889 三个峰与第一主成分呈正相关,并且与 “黄振龙”癍痧凉茶所在区域相对应,说明这三个峰对 “黄振龙”癍痧凉茶的分类起着重要作用。主成分分析的结果表明,黄振龙和平安堂两个厂家的癍痧凉茶之间的化学成分和内在质量具有显着差异,提示配方组成及生产工艺可能不同,应该予以区分。
3 结 论
由 “黄振龙”和 “平安堂”癍痧凉茶的化学成分分析可以看出,两种癍痧凉茶既含有相同的化学成分也含有不同的化学成分。两种癍痧凉茶的液质联用指纹图谱及其主成分分析结果表明 “黄振龙”和 “平安堂”两个厂家的癍痧凉茶之间的化学成分和内在质量具有显着性差异,提示配方组成及生产工艺可能不同,应予以区分。本文所建立的指纹图谱分析方法快速、高效、稳定,是癍痧凉茶质量控制的有效手段。
参考文献:
[1] Yang Y Y,Deng J W,Wu Q H,Yu Y H,Zhong X L. J. Instrum. Anal. ( 杨运云,邓洁薇,吴庆晖,余彦海,钟新林. 分析测试学报) ,2012,31( 12) : 1493 -1498.
[2] Coelho T M,Vidotti E C,Rollemberg M C,Medina A N,Baesso M L,Cella N,Bento A C. Talanta,2010,81( 1/2) : 202 - 207.
[3] Minioti K S,Sakellariou C F,Thomaidis N S. Anal. Chim. Acta,2007,583( 1) : 103 -110.
[4] Yang Y Y,Deng J W,Yu Y H,Zhong X L. J. Instrum. Anal. ( 杨运云,邓洁薇,余彦海,钟新林. 分析测试学报) ,2012,31( 5) : 613 -617.
[5] Xu H Y. Herald Med. ( 许怀勇. 医药导报) ,2009,28( 2) : 218 -220.
[6] Xu L N,Han X,Qi Y,Xu Y W,Yin L H,Peng J Y,Liu K X,Sun C K. Anal. Chim. Acta,2009,633: 136 -148.
[7] Zhang T J,Han S L,Tian C W,Zhu H J. Chin. Tradit. Herb. Drugs( 张铁军,韩世柳,田成旺,朱宏吉. 中草药) ,2010,41( 8) : 1282 - 1285.
[8] Zhao H Z,Meng X S,Ye T X,Liu Z H,Cheng Y,Luo G A. Chin. Tradit. Herb. Drugs( 赵洪芝,孟宪生,叶挺祥,刘征辉,程奕,罗国安. 中草药) ,2010,41( 1) : 48 -51.
[9] Chen Y,Zhu S B,Xie M Y,Nie S P,Liu W,Li C,Gong X F,Wang Y X. Anal. Chim. Acta,2008,623: 146 -156.
[10] Liu Y S,Cao M,Wang Y M,Luo G A. Chin. J. Anal. Chem. ( 刘永锁,曹敏,王义明,罗国安. 分析化学) ,2006,34( 4) : 333 - 337.
[11] Yao W F,Hu Y Z,Mou L L,Yu B Y. Chin. J. Anal. Chem. ( 姚卫峰,胡育筑,牟玲丽,余伯阳. 分析化学) ,2009,37( 3) : 383 - 388.
[12] Wu K X,Gu X,Yan C. Chin. J. Anal. Chem. ( 吴孔弦,谷雪,阎超. 分析化学) ,2009,37( 4) : 581 -584.
[13] Zhoua Y,Xua G,Choi F F K,Ding L S,Han Q B,Song J Z,Qiao C F,Zhao Q S,Xua H X. J. Chromatogr. A,2009,1216: 4847 - 4858.
[14] Zhao L H,Huang C Y,Shan Z,Xiang B R,Mei L H. J. Chromatogr. B,2005,821: 67 -74.
[15] Chen J H,Wang F M,Liu J,Lee F S C,Wang X R,Yang H H. Anal. Chim. Acta,2008,613: 184 -195.
[16] Chen L L,Qi J,Chang Y X,Zhu D N,Yu B Y. J. Pharm. Biomed. Anal. ,2009,50: 127 -137.
[17] Wang H,Feng F. J. Pharm. Biomed. Anal. ,2009,49: 1157 -1165.