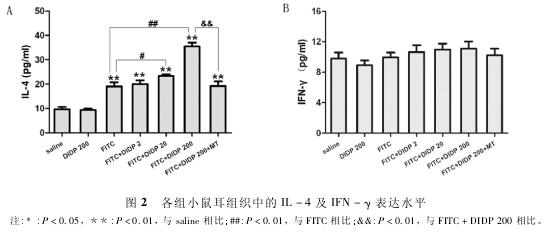
2. 3各组小鼠耳组织中的IL - 4含量 与生理盐水组相比,高浓度的DIDP(200mg /kg /d) 单独作用时未见小鼠耳组织中的IL - 4含量发生显着变化,但0. 5% FITC致敏组(FITC,FITC + DIDP 2,FITC +DIDP 20,FITC + DIDP 200,FITC + DIDP 200 + MT)小鼠耳组织的IL - 4含量均显着升高(P < 0. 01)。与FITC组相比,FITC + DIDP 20组和FITC + DIDP200组小鼠耳组织的IL - 4含量均显着地增加(P <0. 05或P < 0. 01) ( 图2A)。与FITC + DIDP 200组相比,FITC + DIDP 200 + MT组小鼠耳组织中的IL -4含量显着降低(P < 0. 01)。
2. 4各组小鼠耳组织中的IFN - γ含量 不同组别小鼠耳组织匀浆液中IFN - γ的表达水平无显着性差异,表明过敏性皮炎和DIDP不会导致小鼠耳组织Th1型细胞因子IFN - γ的含量发生改变( 图2B)。
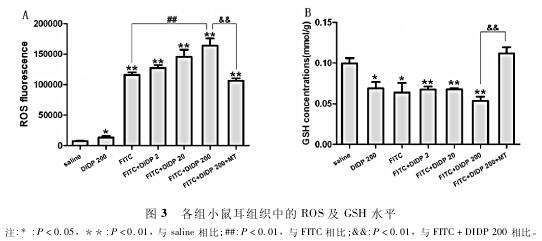
2. 5各组小鼠耳组织中的ROS水平 为了检测耳朵组织中的氧化水平,对耳朵组织中的ROS含量进行测定( 图3A)。与saline组相比,高浓度的DIDP处理(DIDP 200组) 能导致耳组织中ROS含量显着增加(P < 0. 05) ,且0. 5% FITC致敏组(FITC,FITC+ DIDP 2,FITC + DIDP 20,FITC + DIDP 200,FITC+ DIDP 200 + MT) 的小鼠耳组织中ROS含量也显着增加(P < 0. 01)。与FITC组相比,FITC + DIDP 2和FITC + DIDP 20组的小鼠耳部组织中的ROS含量增加但不具有显着性,FITC + DIDP 200组的小鼠耳部组织中的ROS含量则极显着升高(P < 0. 01) .与FITC + DIDP 200组相比,FITC + DIDP 200 + MT组小鼠 耳 部 组 织 中 的ROS含 量 显 着 降 低 (P <0. 01) ,显示MT具有抗氧化作用,能够有效降低组织中的ROS水平。
2. 6各组小鼠耳组织中的GSH含量 为了进一步检测耳朵组织中的氧化水平,对耳朵组织中的GSH含量进行测定( 图3B)。与saline组相比,单独的DIDP经口暴露和0. 5% FITC致敏组(FITC,FITC +DIDP 2,FITC + DIDP 20,FITC + DIDP 200) 均使小鼠耳部组织的GSH含量降低,且FITC + DIDP 200组的降幅最大(P < 0. 01)。与FITC + DIDP 200组相比,FITC + DIDP 200 + MT组的小鼠耳组织中的GSH含量显着升高 (P < 0. 01) ,这表明MT能有效地减轻小鼠耳组织的氧化损伤水平,降低GSH的消耗。
3讨 论
研究发现,大多数过敏性皮炎患者血液中的Ig E含量和抗原特异性T细胞分泌的IL - 4含量升高,但IFN - γ含量会维持在一个相对稳定的水平[16,].因为该类型过敏性皮炎属于Th2型免疫反应,Th2细胞因子如IL - 4可以抑制Th1细胞因子的表达,促进Ig E含量升高,导致Th1 /Th2细胞平衡向着Th2方向偏移。另外,Ig E交联可以导致肥大细胞脱颗粒,进而诱发下游炎症反应。FITC诱导的ACD动物模型的免疫学发病机制与上述过程相似,都属于Th2型免疫反应。利用ELISA法检测了小鼠血清中的Ig E及耳朵组织中的IL - 4和IFN - γ的含量,高浓度的DIDP(200mg /kg /day) 经口暴露后能够有效促进模型组小鼠Ig E和Th2细胞因子IL- 4的表达,而IFN - γ的含量则保持相对稳定,而单独的高浓度的DIDP却没有这种作用,表明DIDP可能作为一种佐剂加重过敏性皮炎。
最新研究发现,在正常生理状态下,自由基如ROS作为一个重要的第二信使参与调节细胞的生理活动[17].但过量的ROS则会通过细胞氧化应激反应诱导细胞凋亡甚至坏死[18].谷胱甘肽(GSH)是机体内重要的抗氧化剂和自由基清除剂[19,20].GSH不仅能清除人体自由基,还可以提高人体免疫力。ROS和GSH含量的变化能有效地评价小鼠耳部组织中氧化应激水平。因此,实验检测了小鼠耳部组织的ROS和GSH含量。与对照组相比,0. 5%FITC致敏的同时可以造成耳部组织的氧化损伤。与FITC组相比,高剂量的DIDP与FITC联合处理能导致小鼠耳部组织中的ROS水平进一步提高(P< 0. 01)。然而,MT处理能有效降低小鼠耳部组织中的ROS含量,减少还原剂GSH的消耗,从而有效减轻组织的氧化损伤。单独的DIDP经口暴露虽然不会导致过敏反应,但可造成小鼠耳部组织一定程度的氧化损伤(P < 0. 05)。
目前,研究发现生物体内ROS的大量积累以及GSH水平的大幅降低会导致体内氧化还原平衡失调,产生氧化应激反应,进而触发下游的炎症反应[21-22].抗原呈递细胞中的GSH水平影响Th1 /Th2细胞平衡,细胞中的GSH水平降低,可能会促进Th2型细胞因子的表达,而抑制Th1型细胞因子的表达[23].另外,在体内积累过量的ROS可能作为一种重要的信号分子诱导炎症因子如IL - 4的表达。因此,推测DIDP与FITC联合作用能恶化过敏性皮炎,并通过氧化应激反应介导。另外,研究发现胸腺基质淋巴生成素(Thymic stromal lymphopoietin,TSLP) 是多种过敏性疾病的一个重要启动因子,可以活化树突细胞,然后进一步诱发Th2型免疫反应。TSLP在一些急性和慢性过敏性皮炎患者的皮肤中过量表达,表明TSLP在过敏性皮炎的发生中发挥着重要作用。推测TSLP可能也参与介导DIDP经口暴露对FITC诱导的过敏性皮炎的恶化作用。
环境中污染物如DIDP长期经口进入人体后,可能会使机体呈现过敏性体质,在遇到过敏原刺激时可以恶化过敏性疾病,且氧化应激反应及其下游分子事件可能是DIDP发挥佐剂作用的一种分子途径。但过敏性疾病种类繁多,机制复杂,且小鼠与人体存在差异,所以本实验并不能完全解释人类过敏性疾病,因此,DIDP等污染物对过敏性皮炎的影响及相关机制还需要更深入的探究。
参考文献
[1] 谢沁珊,王杉杉,蔡凤云,等。塑料增塑剂DEHP环境污染水平、人体负荷及生物毒性的初步研究[J].公共卫生与预防医学,2010,21(5) :19-22.
[2]BANG DY,KYUNG M,KIM MJ,et al. Human risk assessmentof endocrine-disrupting chemicals derived from plastic foodcontainers[J]. Comprehensive Reviews in Food Science andFood Safety,2012,11(5) :453-470.
[3]STRINGER R,LABUNSKA I,SANTILLO D,et al.Concentrations of phthalate esters and identification of otheradditives in PVC children's toys[J]. Environmental Science &Pollution Research,2000,7(1) :27-36.
[4]CHO WS,JEONG J,CHOI M,et al. 26-Week carcinogenicitystudy of di-isodecyl phthalate by dietary administration to CB6F1-ras H2 transgenic mice[J]. Archives of toxicology,2011,85(1) :59-66.
[5]MCKEE RH,PRZYGODA RT,CHIRDON MA,et al. Di(isononyl)phthalate(DINP)and di(isodecyl)phthalate(DIDP)are not mutagenic[J]. Journal of Applied Toxicology,2000,20(6) :491-497.
[6]BORNEHAG CG,NANBERG E. Phthalate exposure and asthmain children[J]. International journal of andrology,2010,33(2) :333-345.
[7]JAAKKOLA JJ,KNIGHT TL. The Role of exposure to phthalatesfrom polyvinyl chloride products in the development of asthmaand allergies:A systematic review and meta-analysis[J].Environmental Health Perspectives,2008,116(6) :845-853.
[8]KIMBER I,DEARMAN RJ. An assessment of the ability ofphthalates to influence immune and allergic responses[J].Toxicology,2010,271(3) :73-82.
[9]LEUNG DYM,SOTER NA. Cellular and immunologicmechanisms in atopic dermatitis[J]. Journal of the AmericanAcademy of Dermatology,2001,44(1) :S1-S12.
[10]CHEN L,MARTINEZ O,OVERBERGH L,et al. Early up-regulation of Th2 cytokines and late surge of Th1 cytokines in anatopic dermatitis model[J]. Clinical & ExperimentalImmunology,2004,138(3) :375-387.
[11]FUCHS J,ZOLLNER TM,KAUFMANN R,et al. Redox-modulated pathways in inflammatory skin diseases[J]. FreeRadical Biology & Medicine,2001,30(4) :337-353.
[12]BRIGANTI S,CRISTAUDO A,D'ARGENTO V,et al. Oxidativestress in physical urticarias[J]. Clinical & ExperimentalDermatology,2001,26(3) :284-288(5)。
[13]RAO MV,CHHUNCHHA B. Protective role of melatonin againstthe mercury induced oxidative stress in the rat thyroid[J]. Food& Chemical Toxicology,2010,48(1) :7-10.
[14]REITER RJ,TAN DX,MAYO JC,et al. Melatonin as anantioxidant:biochemical mechanisms and pathophysiologicalimplications in humans[J]. Acta Biochimica Polonica,2003,50(4) :1129-1146.
[15] 林静,杨文敏,黄元新,等。广西保健食品近三年情况分析[J].公共卫生与预防医学,1999,10(3) :5-8.
[16]TAKESHITA K,YAMASAKI T,AKIRA S,et al. Essential roleof MHC II-independent CD4+T cells,IL-4 and STAT6 incontact hypersensitivity induced by fluorescein isothiocyanate inthe mouse[J]. International Immunology,2004,16(5) :685-695.
[17]STEINMAN L,CONLON P. Antigen specific immunotherapyof multiple sclerosis[J]. Journal of Clinical Immunology,2001,21(2) :93-98.
[18]EUA. Department of Health and Human Services. Agency fortoxic substances and disease registry. toxicological profile for di-n-butyl-phthalate[J]. Priority Substances List AssessmentReport,2001,18(3) :187-191.
[19]MATSUE H,EDELBAUM D,SHALHEVET D,et al. Generationand function of reactive oxygen species in dendritic cells duringantigen presentation[J]. Journal of Immunology,2003,171(6) :3010-3018.
[20] 陈燕,樊柏林,田洁,等。虾青素人参茶叶对老龄小鼠的抗氧化作用[J].公共卫生与预防医学,2016,26(2) :89-91.
[21]FUCHS J,ZOLLNER TM,KAUFMANN R,et al. Redox-modulated pathways in inflammatory skin diseases[J]. FreeRadical Biology & Medicine,2001,30(4) :337-353.
[22]D 'AUTREAUX B,TOLEDANO MB. ROS as signallingmolecules:mechanisms that generate specificity in ROShomeostasis[J]. Nature Reviews Molecular Cell Biology,2007,8(10) :813-824.
[23]OH PS,LIM K,LIM KT. Phytoglycoprotein(75 k Da)inhibitsexpression of interleukin-1beta stimulated by DEHP in humanmast cells[J]. Cell Biochemistry & Function,2010,28(5) :352-359.