
几丁质是昆虫身体的重要组成部分,也是昆虫防止机械损伤和生物侵害的屏障。昆虫在蜕皮期间必须降解几丁质,才能蜕去旧表皮替换新表皮,进行正常的生长发育。几丁质酶是几丁质降解酶系重要的成员,属于糖苷水解酶 18 家族,能够将几丁质聚合物分解成壳糖乙糖苷和乙酰葡萄糖胺糖苷两个部分(Dahiya et al.,2006) 。几丁质酶广泛存在于各种真菌、植物、昆虫和鱼类等生物中。昆虫几丁质酶与昆虫的周期性蜕皮相关,主要有几丁质酶和 β-N-乙酰葡萄糖胺酶,它们都影响昆虫的正常生长发育(Yamagami et al.,1998) 。此外,昆虫的几丁质酶也可作为防卫因子,抵抗含几丁质的害虫和病原物,如对昆虫围食膜或体壁、线虫的卵壳、真菌细胞壁进行降解(Sahai & Manocha,1993; Kramer & Muthukrish-nan,1997) ; 还可通过水解释放出一些相关物质来调动植物的防御反应(Garcia et al.,1997) 。
高低温胁迫可干扰昆虫的生理机能,导致其代谢紊乱,免疫防御能力下降。低温可降低蚊子 Aedesaegypti 的免疫力,使其对某些病毒更加易感 (Adel-man et al.,2013) 。因此昆虫需要通过多样化的适应机制和代谢方式进行种群的延续。荒漠昆虫小胸鳖甲 Microdera punctipennis 是准噶尔盆地的特有种(黄人鑫等,2005) ,能够很好地适应沙漠环境的极端温度(Hou et al.,2010; Wang et al.,2011) 。通过对小胸鳖甲的 4℃低温转录组测序发现,几丁质酶基因 Mp-chi786 具有低温诱导性,参与小胸鳖甲的低温响应,与对照组相比,4℃处理 3 h 后该基因的上调倍数为10. 52。目前关于昆虫几丁质酶功能研究报道较多(Merzendorfer,2013) ,但是还未发现有低温诱导的相关报道。在植物、真菌和细菌中,几丁质酶参与细胞壁的重构,在受到生物或非生物胁迫时可以通过将几丁质降解为小分子物质来调节体内渗透平衡(Bhattacharya et al.,2007; Alcazar-Fuoli et al.,2011) 。
例如,番荔枝 Annona cherimola 几丁质酶基因具有两个抗真菌并与低温适应性相关的几丁质酶基因(Go?i et al.,2013) 。为了深入研究几丁质酶在昆虫低温响应中的表达情况,本研究通过 DNA-蛋白质联合免疫法制备了小胸鳖甲几丁质酶 MpCHI786 抗血清,ELISA 及 Western blot 检测结果表明,抗血清具有高效价并能特异性地与 MpCHI786 反应。
1、 材料和方法
1. 1 试剂与试虫
DNase Ⅰ、dNTP Mixture、RNase Inhibitor、Oligo(dT) 、Reverse Transcriptase M-mLV (RNaseH-) 、DNA Marker、Taq DNA 聚 合酶、T4 DNA 连接酶及EcoRⅠ和 XholⅠ等限制性内切酶均为大连 TaKaRa公司产品; DNA 片段回收试剂盒为上海生工生物工程技术服务公司产品; DNase/RNase-Free ddH2O、TRIzol 试剂均为 Invitrogen 产品; 弗氏不完全佐剂和完全佐剂购自美国 Sigma 公司; HRP 标记的山羊抗鼠 IgG 购自武汉博士德生物工程有限公司; 大肠杆菌 DH5α 和 BL21 为北京全式金生物技术有限公司产品; 其余常用试剂为国产分析纯试剂。
新疆荒漠昆虫小胸鳖甲 Microdera punctipennis采自于新疆阜康市 222 团(44°24'N,87°51'E) 的准噶尔盆地古尔班通古特沙漠南缘地带。
1. 2 真核表达载体 pcDNA3. 0-Mpchi786 的构建及瞬时表达
根据转录组测序获得的小胸鳖甲几丁质酶 Mp-chi786(转录组测序结果中的 ID 号: comp786 _ c0 _seq1) 序列设计引物,扩增 Mpchi786 全长。引物设计了酶切位点(表 1) 以便后续克隆。提取小胸鳖甲成虫的 总 RNA,Reverse Transcriptase M-mLV (RNaseH-) 酶反转录得到 cDNA。以 cDNA 为模板,EcoRI-Mpchi786-F 和 XholI-Mpchi786-R 为引物进行 PCR 扩增,反应条件为 94℃ 预变性 5 min; 94℃ 变性 30 s,58℃ 退火 30 s,72℃ 延伸 30 s,35 个循环; 72℃ 延伸7 min; 4℃ 结束。使用 PCR 产物回收试剂盒回收 PCR产物,使用 EcoRⅠ和 XholⅠ双酶切 pcDNA3. 0 载体和PCR 产物,将目的片段与载体相连,转化 DH5α。在含有氨苄青霉素50 μg/mL 的固体 LB 培养基上筛选阳性菌落,提取质粒,进行酶切和测序鉴定。鉴定正确的重组质粒采用碱裂解法大量制备,以 PEG8000 沉淀纯化后溶于灭菌的生理盐水中备用。
选择4 ~5 周龄(约20 g) 的健康昆明白小鼠,将纯化的 pcDNA3. 0-Mpchi786 质粒用生理盐水稀释至浓度为 10 μg/mL 总体积 2. 5 mL,采用尾静脉大容量快速注射法,8 h 后取其肝脏,采用 TRIzol 法提取总 RNA,经过 DNaseI 消化后,反转录进行 RT-PCR,所用引物为上述特异性引物,扩增参数不变。对照组用同样的方法注射生理盐水。扩增的产物用 1%的琼脂糖凝胶电泳检测。
1. 3 His-MpCHI786 的诱导表达与纯化
将 Mpchi786 构建到质粒 pET30a 上,然后将鉴定正确的 pET30a-Mpchi786 重组质粒转入大肠杆菌E. coli BL21。挑取测序正确的 E. coli BL21 / pET30a-Mpchi786 单菌落,37℃ 培养过夜,次日按 1% 的比例接种于 10 mL 的 LB(Kana+) 培养基中进行 37℃培养。当菌液 OD600的值达到 0. 4 ~ 0. 6 时,加入终浓度为 0. 5 mM 的异丙基硫代半乳糖苷(IPTG) 进行诱导,37℃振荡培养,分别于 1 h、2 h、3 h、4 h、5 h、6 h、7 h、16 h、17 h 确定最佳的诱导时间。以不加 IPTG诱导的菌液为对照,分别取适量的诱导表达菌,进行SDS-PAGE 鉴定表达的蛋白。
切胶纯化蛋白,即包涵体经过 SDS-PAGE 电泳后,将目的条带从胶上切下,研钵中研碎后加入 PBS缓冲液溶解蛋白,然后 12 000 rpm 离心 10 min 后取上清进行 SDS-PAGE 电泳鉴定蛋白纯度。
1. 4 抗血清的制备及效价测定
采取注射生理盐水组的昆明白小鼠血清作为对照。用 100 μg pcDNA3. 0-Mpchi786 重组质粒免疫昆明白小鼠,免疫 3 次,每次间隔 14 d,第 4 次使用50 μg的 His-MpCHI786 蛋白与等体积的弗氏完全佐剂充分乳化后于小鼠背部进行皮下注射,间隔 14 d后用等体积的弗氏不完全佐剂乳化融合蛋白 His-MpCHI786 进行注射(80 μg) ,每次免疫前收集小鼠血清存放于 -80℃冰箱保存。
通过间接 ELISA 法测定抗血清的效价。以纯化的 His-MpCHI786 为抗原进行包被,4℃ 过夜,洗涤。
加不同稀释度的待测抗血清,PBS 为空白对照,生理盐水对照组小鼠的血清为阴性对照。37℃孵育 2 h,洗涤,加 HRP 标记的羊抗鼠二抗(1∶10 000 稀释度)37℃ 孵育 1 h,洗涤。加入新配制的 TMB 显色液,37℃避光反应30 min 后,加终止液。在酶标仪上测450 nm下的 OD 值,样本光吸收值大于或等于阴性数值的2. 1 倍,即可判定为阳性(Ausubel et al.,1999) 。
1. 5 小胸鳖甲成虫总蛋白的提取
参照杨颖等(2011) 配制水溶性蛋白裂解液(100 mmol/L Tris,7 mol/L 尿素,0. 02 mol/L EDTA,65 mmol / L DTT) ,临用前加入终浓度为 l mg / mL 的PMSF,冰浴 30 min。将小胸鳖甲 7 龄幼虫(个体最大的幼虫) 用灭菌的 H2O 冲洗干净,用液氮研磨后溶于抽提液中冰浴 30 min。12 000 r/min 于 4℃ 离心20 min,上清液即为小胸鳖甲总蛋白。利用 Bradford法,以牛血清白蛋白作标准曲线,测定蛋白含量。
1. 6 Western blot 检测抗血清的特异性和敏感性
Western blot 检测参照 Bio-Rad 公司的实验指导,将 20 μg 的 His-MpCHI786 蛋白进行 12% SDS-PAGE 电泳,之后采用 Mini-PROTEAN 3 Trans-Blot系统(伯乐) 将提取的小胸鳖甲总蛋白转移到 PVDF膜(醋酸纤维素膜) 上。PVDF 膜经过一抗(MpCHI78抗血清) 和二抗(HRP) 处理后于 DAB 中进行显色,显色时间约为 2 min。
2、 结果
2. 1 pcDNA3. 0-Mpchi786 重组质粒的构建及瞬时表达
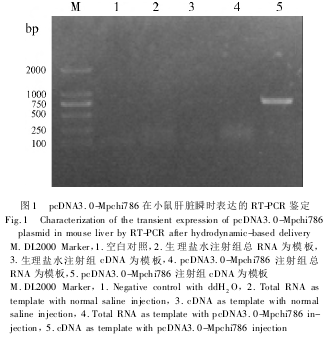
Mpchi786 基因全长(744 bp) 的 PCR 产物经纯化后,用 EcoRⅠ和 XholⅠ双酶切,与经过相同酶切的 pcDNA3. 0 载体连接转化后,经质粒提取和酶切鉴定,初步证明 pcDNA3. 0-Mpchi786 构建正确。测序结果证实了构建的正确性。为了验证 pcDNA3. 0-Mpchi786 是否可以作为 DNA 免疫的有效质粒,用该重组质粒对小鼠进行尾静脉高压注射,瞬时表达结果表明,pcDNA3. 0-Mpchi786 能够在小鼠肝脏细胞内转录表达,与预期的 744 bp 大小一致(图 1) 。
2. 2 His-MpCHI786 融合蛋白的诱导表达与纯化
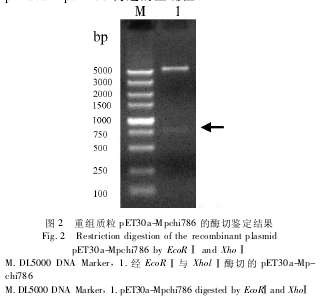
先构建原核表达质粒 pET30a-Mpchi786,将 Mp-chi786 基因的全长 PCR 产物纯化后,用 EcoR Ⅰ 和XholⅠ双酶切,并与经过相同酶切的 pET30a 载体连接。重组子经转化后,提取质粒,双酶切获得约750 bp的条带,初步鉴定构建正确(图 2) ,测序结果证实pET30a-Mpchi786 构建的正确性。
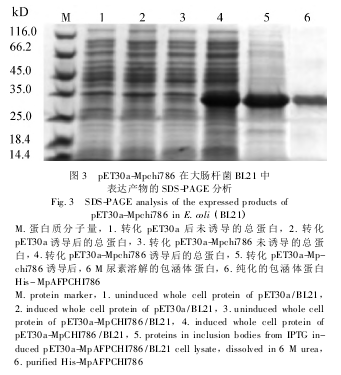
将鉴定正确的阳性重组质粒 pET30a-Mpchi786转化至 E. coli BL21 菌株,菌落 PCR 鉴定阳性菌株后,以 0. 05 mmol/L 的 IPTG 诱导培养 5 h,结果表明重组 His-MpCHI786 蛋白在大约 30 kD 有大量表达(图 3,泳道 4) 。对比重组质粒 pET30a-Mpchi786 和空质粒 pET30a 的表达产物可见,His-MpCHI786 蛋白主要存在于沉淀部分(图 3,泳道 5) ,以包涵体形式存在,切胶回收后的样本于 SDS-PAGE 中仅可见His-MpCHI786 融合蛋白单一条带(图 3,泳道 6) 。
2. 3 MpCHI786 抗血清的效价
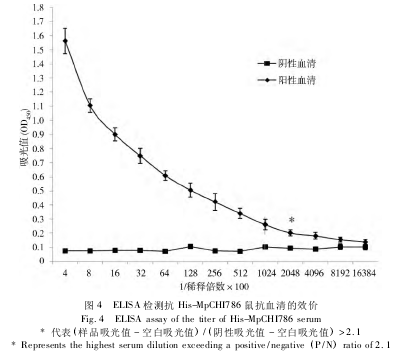
采用 DNA-蛋白联合免疫法,重组质粒 pcDNA3.0-Mpchi786 免疫 3 次,血清效价约为 1∶ 100。再以融合蛋白 His-MpCHI786 免疫2 次,以生理盐水免疫组血清为阴性对照,末次加强免疫后小鼠血清从1∶400开始倍比稀释,用间接 ELISA 测定抗体的效价,结果表明,联合免疫的鼠抗血清的抗体效价均达到了1∶204 800(图4) ,表明在小鼠体内产生了高效价的抗体。
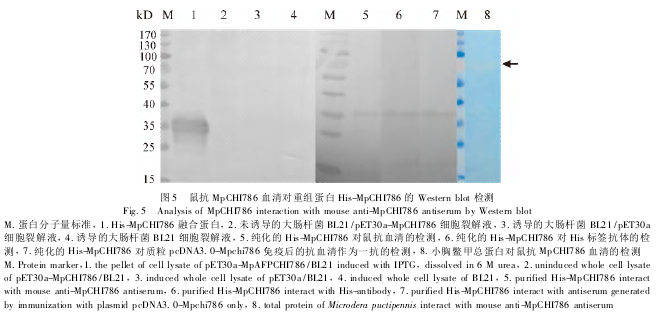
2. 4 MpCHI786 抗血清的 Western blot 检测
以诱导表达的包涵体蛋白 His-MpCHI786 为阳性对照,携带重组质粒但未诱导的大肠杆菌细胞裂解液、诱导的携带空载体的大肠杆菌细胞裂解液、诱导的不携带质粒的细胞裂解液为阴性对照,Western blot检测显示,在约30 kD 处形成了特异的抗原-抗体免疫反应条带,表明 DNA-蛋白质联合免疫所制备的 Mp-CHI786 抗血清对 His-MpCHI786 融合蛋白有特异性(图5,泳道1 ~4) 。用纯化的 His-MpCHI786 检测 His抗体也获得了特异性条带(图5,泳道 6) ,表明由于用His-MpCHI786 加强免疫,也会产生对 His 的抗体。而用 His-MpCHI786 检测质粒 pcDNA3. 0-Mpchi786 免疫后的抗血清,在相同大小的位置也出现了特异的抗原-抗体免疫反应条带(图 5,泳道 7) ,证实所制备的抗血清是针对 MpCHI786 产生的特异性抗体。提取小胸鳖甲的总蛋白,当总蛋白上样浓度达到大约 600μg 时,能够在 70 kD 处检测到目的条带,其大小约为预期条带大小的2 倍(图5,泳道8) 。
3、 讨论
昆虫利用几丁质酶来抵御病原真菌或其他寄生物的寄生(Gooday,1999) 。荒漠昆虫小胸鳖甲作为古尔班通古特沙漠的特有种,其几丁质酶是否还能在抵抗环境胁迫带来的生理机能适应过程中发挥作用有待于进一步通过分子生物学的手段来证明,而制备特异性强、高效价的几丁质酶抗体是深入开展相关研究的基础之一。
本研究利用“DNA 初免-蛋白质加强”策略制备了效价达 1∶ 204 800 的特异性抗血清,该方法被认为可在较大程度上提高 DNA 疫苗的利用性(Ramsayet al.,1999; Gorelick et al.,2000) ,DNA 疫苗与蛋白疫苗联合免疫能显著提高抗血清的效价,提高抗体的专一性(Reyes-Sandoval et al.,2010; Zhou et al.,2012) 。李洁琼等(2013) 通过此方法制备了较好的抗体。本研究以 pcDNA3. 0 质粒作为真核表达载体,以小胸鳖甲几丁质酶基因 Mpchi786 为目的基因,构建了 pcDNA3. 0-Mpchi786 重组质粒作为 DNA疫苗。该质粒除了具有一个新霉素抗性标志外,在哺乳动物细胞中不表达其他蛋白,所以能够激发目的蛋白的特异性抗体,具有特异性强的优势。在免疫之前通过对小鼠进行尾静脉高压注射,使 DNA 疫苗在小鼠肝脏大量瞬时表达,可以验证所构建的DNA 疫苗是否能有效表达 (Liu et al.,1999; Zhanget al.,2004 ) 。本研究中,pcDNA3. 0-Mpchi786 重组质粒与各种阴性对照相比,能够在小鼠肝脏特异性表达,确保了 DNA 初免的有效性。在末次核酸免疫之后,采取抗血清进行 Western blot 检测,获得了与His-MpCHI786 融合蛋白结合的特异性条带,证明了pcDNA3. 0-Mpchi786 的 DNA 免疫可以激发针对MpCHI786 的特异性抗体。
由于 DNA 免疫激发的抗体效价通常较低(Jinet al.,2004 ) ,所以我们构建了原核表达质粒pET30a-MpCHI786,通过诱导表达、切胶回收包涵体蛋白得到大量融合蛋白 His-MpCHI786,以此作为抗原进行蛋白疫苗的加强免疫。包涵体的切胶回收,保证了 His-MpCHI786 融合的纯度,通过 Westernblot 验证了最终所制备 MpCHI786 鼠抗血清的特异性。由于融合蛋白中含有 6 个组氨酸的 His 标签,在免疫过程中 His 标签会产生抗体,利用这一特性采用 His 抗体进行 Western blot 检测,不仅显示了所制备抗血清的特异性,也显示了几丁质酶 MpCHI786的大小。使用昆虫总蛋白对最终所制备的抗血清进行检测,在总蛋白量约 600 ng 时可检测到 Mp-CHI786 的存在,但是其大小约为预期大小的 2 倍,可能在体内是以二聚体或其他修饰状态存在,进一步说明制备的抗血清具有高度特异性。
采用 SDS-PAGE 凝胶电泳分离原核表达产物,并切胶回收目的蛋白的方法获得纯度较高的抗原是一种成熟可靠的方法,可用于抗体的制备并已有许多成功的例子(Sambrook et al.,1992; 韩月恒等,2003; 郝婵娟等,2005) 。本研究也进一步证实了切胶回收的蛋白仍能保留原有的抗原性,与传统的方法相比较,切胶纯化方法简单、经济适用。本研究采用 DNA-蛋白质联合免疫策略制备了小胸鳖甲几丁质酶 MpCHI786的高效价、特异性小鼠抗血清,为深入开展荒漠昆虫小胸鳖甲几丁质酶的组织特异性表达及其在荒漠环境适应性中的功能研究提供了基础。
4、 参考文献:
1.韩月恒,张文红,沈岚,等. 2003. OS-9 基因的融合表达、纯化及多克隆抗体制备[J]. 中国生物化学与分子生物学报,19 (3) :327-331.
2.郝婵娟,柴宝峰,王伟,等. 2005. 烟草天蛾几丁质酶的表达,纯化及多克隆抗体制备[J]. 昆虫学报,48(32) : 337-341.
3.黄人鑫,吴卫,毛新芳,等. 2005. 新疆荒漠昆虫区系及其形成与演变[M]. 乌鲁木齐: 新疆科学技术出版社: 36-46.
4.李洁琼,侯晓娟,王岩,等. 2013. 拟步甲科昆虫不同抗冻蛋白的免疫交叉性分析[J]. 细胞与分子免疫学杂志,29(9) : 976-980.
5.杨颖,徐代勋,曲勃,等. 2011. 梅花鹿鹿茸总蛋白的提取方法比较[J]. 特产研究,2: 11-12.





