摘 要: 昆虫DNA条形码序列(DNA Barcoding)检测鉴定技术是利用昆虫的一个或多个mtDNA、rDNA片段碱基序列的差异对昆虫进行分类阶元、种下阶元遗传进化分析的一项分子生物学方面的数字化检测技术。这一技术给昆虫分类鉴定、种群分化分析、隐存种、新种的发现提供了新的技术参考手段。现阶段DNA条形码中部分片段的基因序列已在昆虫分子生物学研究中得到了广泛的应用,在新时代信息化发展的今天,昆虫DNA条形码检测技术对昆虫分类学影响较大,具有重要的理论和现实意义;相对的,由于昆虫种类繁多,同种中存在雌雄二型现象、不同地里种等问题,使部分种类遗传系统发育研究结果与形态学相搏,故DNA条形码技术单纯依靠序列碱基差异分析结果存在一定的局限性,因此一个可靠的分析研究结果是应与传统形态学相结合的。本文主要阐述了DNA条形码技术原理,相关基因序列种类,并详细介绍了COⅠ、COⅡ、Cytb、18S rRNA、28S rRNA等基因序列的特点和应用昆虫种类的研究,简要讨论和展望DNA条形码技术在昆虫分子生物学中的应用前景。
关键词: DNA条形码; 昆虫; 基因序列;
Abstract: The detection and identification technology of insect DNA Barcoding is a digital detection technology in molecular biology,which uses the difference of base sequence of one or more mtDNA and rDNA fragments of insects to analyze the genetic evolution of taxonomic elements and subspecies. This technique provides a new technical reference for insect classification and identification,population differentiation analysis,hidden species and new species discovery. At present,some gene sequences of DNA Barcoding have been widely used in insect molecular biology research. With the development of information technology in the new era,insect DNA Barcoding detection technology has a great impact on insect taxonomy,which has important theoretical and practical significance. Relatively,due to the wide variety of insects,there are hermaphroditism in the same species and species in different places The problem is that the results of genetic phylogeny of some species are in conflict with morphology. Therefore,DNA barcoding technology only relies on sequence base difference analysis results,which has certain limitations. Therefore,a reliable analysis and research result should be combined with traditional morphology. In this paper,the principle of DNA barcoding technology and the types of related gene sequences were introduced. The characteristics of gene sequences such as CO Ⅰ,CO Ⅱ,Cytb,18 S rRNA and 28 s rRNA were introduced in detail. The application prospect of DNA barcoding technology in insect molecular biology was briefly discussed and prospected.
Keyword: DNA barcoding; insects; gene sequence;
近年来,随着全球工业化发展和气候异常变化,众多昆虫种类濒临灭绝。对现存昆虫种群多样性、分子生态学的研究,记录并保存已鉴定昆虫种类势在必行。早在2003年,加拿大圭尔夫大学的保罗·赫伯特科研团队首次采用了DNA条形码序列做为物种鉴定的平台。在以往普通昆虫学物种鉴定的概念里,昆虫种类的确定主要依靠昆虫头部、触角、翅、足等外部形态的区别,昆虫形态学家大都是依靠形态特征进行分类。近年来多学科的融合发展,分子生物学与昆虫分类学的结合,利用昆虫遗传学特征进行鉴定,如昆虫mt DNA被众多学者研究利用,使昆虫分类学有了新的手段[1]。如此方式把分子生物学和遗传学适当地结合起来,不但提高了工作效率,而且使鉴定工作有据可依,同时为昆虫不同分类阶元、种下阶元鉴定分析提供新的参考。对研究系统发育和进化关系、发现新种和隐存种等方面也可提供参考[2]。目前,可用作检测分析核酸序列主要特征是:具有高度识别能力,分类覆盖广[3]。自1758年由瑞典博物学家林奈提出生物类群命名原则后,随后DNA条形码的问世,对昆虫进化分类学、支序分类学和表征分类学的发展具有重要意义[4,5]。

1、 DNA条形码技术原理
建立DNA条形码基因序列库的目的是构建一个公用的、多种的、方便的,可为有需要的学者提供参考借鉴的基因库系统,这种概念的产生源自于商超商品的条码识别系统[6]。可用作检测分析的DNA条形码序列长度约500 bp,每个位点有4个碱基,约10亿种组合,足可覆盖现有已知的动植物总数。由于生物进化稳定且漫长,每个物种都具有一批相对稳定的基因位点,可通过诱发编码基因突变、增加编码基因数量来改变现有状态。通常,蛋白质的第三密码子容易诱发突变。现阶段昆虫检测分析中,通过引物提取一般可获得长度约600 bp的DNA碱基序列,根据生物每百万年2%的进化速率,现在具有生殖隔离的昆虫物种类群,600 bp的DNA序列中平均就有12组碱基位点可用于识别分析,不同的近缘种、隐种百万年进化后形态学上往往存在差别,这都是基因的差异和选择性表达的结果。所以昆虫的一个或多个mt DNA、r DNA片段可作为检测鉴定分析的方法[3]。
2、 昆虫DNA条形码种类的研究
现阶段针对条形码的研究方向有线粒体基因(mt DNA)和核基因(r DNA)[7,8]。文献里出现的昆虫序列片段如表1(表1)[9,10,11,12,13,14,15,16,17,18,19]。
表1 序列片段统计
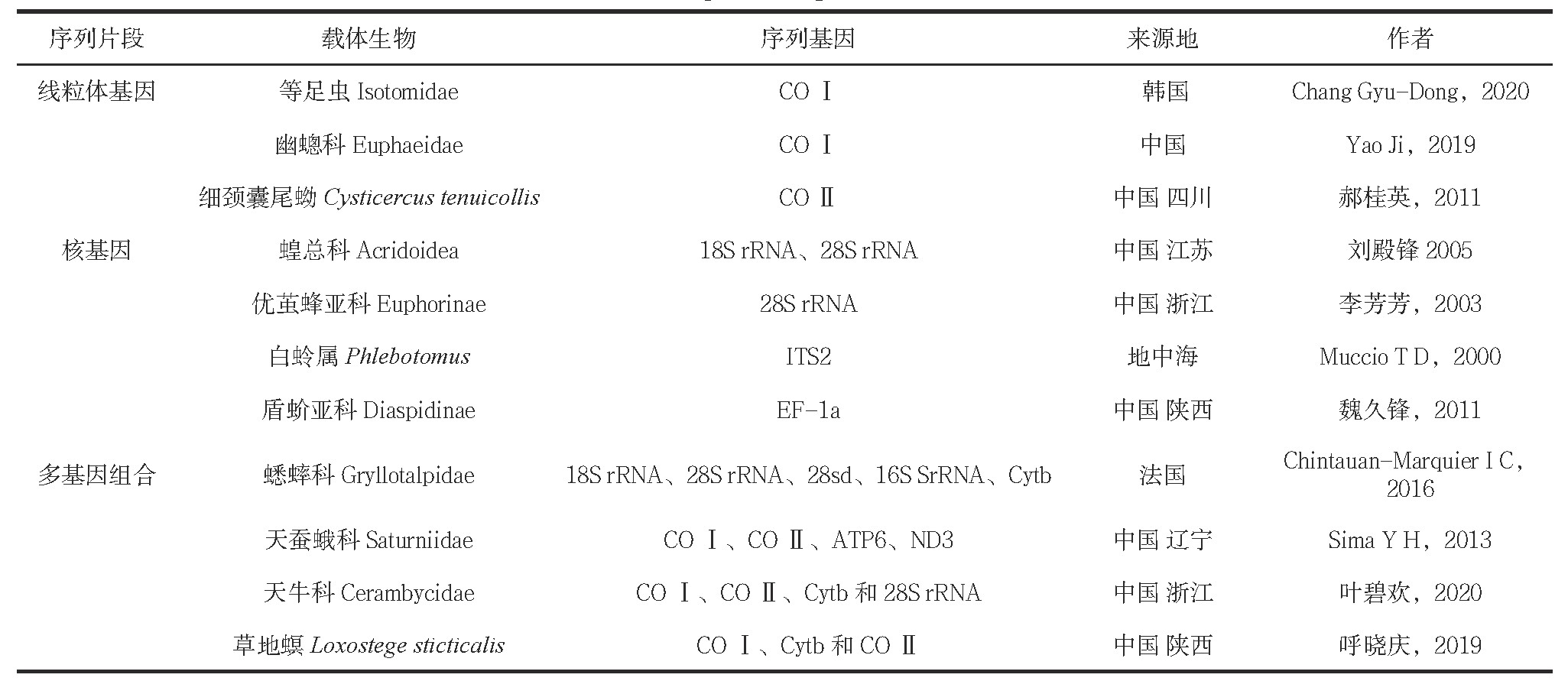
3、 昆虫DNA条形码的研究概况
目前,mt DNA、r DNA序列片段已被广泛应用于昆虫的分类阶元和种下阶元研究分析,既有采用单一基因序列,也有两种基因序列或多种基因序列组合研究,但目前关于昆虫分子分类DNA条形码的选择还没有一个统一的标准。
3.1 、COⅠ基因及应用
一般昆虫COⅠ基因碱基1 500 b P左右,约编码500个氨基酸,是现代昆虫分类中常被用来分析近缘种、系统进化发育关系、种类鉴定的候选基因序列[3]。COⅠ基因是线粒体蛋白编码基因之一,密码子第三位碱基稳定性较差易变异,且COⅠ的进化速率远高于它蛋白编码基因,碱基间的差异可作为区分物种区分的标记,较其它基因序列而言,COⅠ基因少有插入和缺失基因,两端序列保守且稳定,适用于分子标记,目前在昆虫分子生物学中已广泛应用[20]。
晏毓晨等[21]基于COⅠ序列对中国浙江天目山危害短梗稠李(Padus brachypoda)的丑锤角叶蜂属(Zaraea mengmeng)进行系统发育研究,发现了一新种萌萌丑锤角叶蜂,且新种分子分析结果与形态鉴定结果一致,均支持新种成立;张鹏飞等[22]利用COⅠ基因序列对内蒙古草原上的害虫沙葱萤叶甲(Galeruca daurica)进行分子生物学研究,结果表明沙葱萤叶甲不同地里种群间遗传分化较小,且遗传分化主要来自种群内部(96.34%),且种群间未发生明显的遗传分化,各种群间遗传分化程度与地理距离无显着相关性;聂跃等[23]采用COⅠ基因序列对云南、海南、河内、越南等热带地区橡胶树(Hever brasiliensis)上的11个不同地理种群的165头样本进行了种下阶元遗传分化研究,结果表明11个种群的六点始叶螨(Eotetranychus sexmaculatus)存在一定遗传分化差异。常虹等[24]对江苏检验检疫口岸截获的类小蠹科(Scolytidae)82种昆虫进行线粒体COⅠ基因序列研究,进一步区划了小蠹科种间亲缘关系,并构建了条码基因库。
3.2、 COⅡ基因及应用
昆虫中COⅡ基因是mt DNA的一个片段,长度约680 bp,编码230个氨基酸左右,位点比较保守[7]。在昆虫分子生物学研究中,COⅡ基因具有较多的碱基信息进化位点,是理想的昆虫分子鉴定工具。与COⅠ基因序列一同,COⅡ基因目前已被众多学者用于讨论昆虫种间遗传进化分析、DNA分子标记鉴定、隐种的发现等[25]。此外,COⅡ基因易获得,且信息进化位点相对保守稳定,在昆虫分类阶元分析研究中得到广泛应用[26]。但也有研究发现,单独利用COⅡ基因序列对昆虫种下阶元分析研究的结果不理想,与现有形态学记载存在略微差异,但结合mt DNA、r DNA其它基因以及与形态学资料整合研究,效果理想[27]。
Agne`s等[28]认为可采用COⅠ基因和COⅠ基因研究分析法国黑蜜蜂保护区的黑蜜蜂(A m scutelata)地理种群间的遗传分化分析,根据分析结果制定黑蜜蜂保护法;Matthew N等[29]基于16S、COⅠ、COⅡ基因研究发现巴氏杆菌不是单系的,而是由两个主要的分支组成:Bactrocera s.s.和“Zeugodacus亚属群”;谭文静[30]基于线粒体COⅠ基因和COⅡ基因序列对云南省横坑切梢小蠹(Tomicus minor)种群的遗传多样性研究,研究结果揭示云南省横坑切梢小蠹不同地理种群间基因流水平一般,7个种群间的遗传分化与地理距离没有显着的相关性;Kimura等、Sperling等[31,32]利用COⅡ对昆虫亲缘关系和遗传分化分析,得到理想结果;另一方面,季英华等[33]对9个灰飞虱(Laodelphgax striatellus)地理种群的COⅡ基因进行克隆测序,序列分析结果显示:不同灰飞虱地理种群的COⅡ基因碱基序列组成相似度极高(99%以上),无明显的遗传分化差异,这说明COⅡ基因不适合用于部分昆虫地理种群的划分。
3.3 、Cytb基因及应用
细胞色素b(Cytb)位于线粒体内膜磷脂双层中,作为电子载体是细胞内传递电子的重要环节。与mt DNA基因组中的COⅠ基因、COⅡ基因相比,Cytb基因进化速度适中,较短的碱基序列可用作昆虫种间亲缘关系研究分析,更适合研究种内到种间甚至科间的系统发育关系,是讨论昆虫种间阶元遗传变异的有效辅助工具[34]。
杨瑞生等[35]应用线粒体Cytb基因序列探讨柞蚕饰腹寄蝇(Blepharipa tibialis)部分属间的系统发育关系,系统进化树表明柞蚕饰腹寄蝇等32种双翅目昆虫从科的水平上与形态学一致,Cytb基因可用作双翅目昆虫科以上的系统发育关系研究;Maite等[36]在法医鉴定中对丽蝇科(Calliphoridae)利用Cytb基因得到理想结果,使鉴定结果有数字依据。任竹梅等[37]基于Cytb基因序列对蝗总科(Acrididae)8个科10个种进行了遗传进化分析,并发现分子学分化结果与形态学不完全一致。
3.4 、18S r RNA、28S r RNA基因应用
真核生物染色体上编码核糖体小亚基的基因叫做18S r RNA,因18S r RNA基因二级结构高度保守,在蛋白质合成中具有重要的功能,故该基因序列适用于昆虫系统发育研究。28S r RNA基因遗传变异小,进化稳定,是真核生物的染色体上编码核糖体大亚基的基因。与18S r RNA相比,28S r RNA变异性较大,同样可为昆虫分子系统发育研究提供技术手段。18S r RNA、28S r RNA序列相对而言比较保守,一般适用于科以上分类单元的系统发育研究。
众多学者用18S r RNA和28S r RNA序列研究昆虫的分子系统学。例如,刘殿锋[19]应用18S r DNA和16S r DNA序列对蝗总科昆虫的系统进化进行研究,发现斑腿蝗科并非是一单系群,斑腿蝗科分子进化树的聚类分析结果与形态学的分类体系有较大差异。Gisele Amaro Teixeira等[38]用18S r DNA对17种切叶蚁(Myrmeina)进行了分子系统进化发育研究,结果表示18s r DNA基因的染色体对大小存在差异,这突出了物种之间的差异。贾晨曦[39]结合线粒体16S r RNA以及核28S r RNA基因序列,讨论了北方金龟科(Scarabaeidae)昆虫不同亚科间、族的分类地位和系统发育关系,证明该基因序列是研究金龟科昆虫种间系统发育研究的一个良好基因。
3.5、 其它
12S rRNA、16S rRNA、ND5、Bmamy 2、ITS-1等也有过一些报道,但相对于COⅠ、COⅡ、Cytb等基因来说算是昆虫分子生物学研究中的小冷门。
ITS2基因序列是属和种水平上进行系统发育分析的常用区域之一[40];白映禄等[41]对甘肃省叶螨属(Tetranychus)和全爪螨属(Panonychus)的27个叶螨进行了ITS1序列研究分析,发现ITS1序列与其中5种在形态学上相符,ITS1对叶螨种群分子生物学鉴定可行有效;杜周和[42]基于Bmamy 2基因序列对家蚕起源进行遗传分化研究分析,分子进化树显示90个家蚕地方品种聚类成三大簇群,其结果与不同地里种分类结果一致;田嵩浩等[43]研究发现,EF-1α基因适用于中国境内19个地区的东方蜜蜂(Apis cerana)种间的系统发育研究,但不能用于该种的种内系统发育研究;尚北晨[44]将COⅠ和ND5基因用于香梨优斑螟(Euzophera pyriella)种群遗传结构研究分析,发现大多数地理种群间遗传分化不显着,有些种群间还存在基因交流频繁的现象。
4 、问题和展望
每种昆虫都具有不同的形态学特征,形态学鉴定一直是昆虫分类学最常用、最基本的技术手段。相对的,采用DNA条形码技术鉴定昆虫和系统发育分析研究的方法问世后,争议随之而来,主要分歧是目前分子生物学发展的局限性和传统形态分类学长期遗存的技术观点。传统依靠形态差异定种是昆虫分类学的基础,是不可或缺的,DNA条形码技术虽发展迅速,但只是昆虫鉴定工作良好的辅助工具;分子生物学的理论核心大多是分子仪器、相关软件程序分析的数字结果,如此便降低了专业技术人员最基本的鉴别能力,并不利于昆虫学研究发展。在NCBI、EBI、PADIL等较主流的DNA条形码技术研究网站上,以研究数据库较多的COⅠ基因序列为例,网站上传显示的昆虫种类远不及现已记载描述的昆虫种类,由于技术和监管等方面的欠缺,各大网站上还存在与描述种类不相符的序列信息;由于昆虫种类繁多,DNA条形码序列片段的不同,昆虫的分子生物学鉴定并没有统一的技术标准。
快速而准确的物种鉴定是深入开展行为学、生态学以及生理学等方面研究的前提和基础。DNA条形码检测技术较低的入门门槛、便捷的操作方式、数据化的分析结果为众多昆虫分类学学者提供了新的技术手段,是当前昆虫分子生物信息学的主流研究方向。同时,DNA条形码检测技术给物种分类鉴定提供新参考,它可精准、直观的获得昆虫的鉴定信息,加快了昆虫分类鉴定工作的脚步。另一方面,传统形态学、生理学、生态学等方面学科的资料作为昆虫分类学研究基础至关重要;因此,形态学和分子生物学的结合可使昆虫鉴定结果更有说服力。
参考文献
[1] Swofford D L,Olsen G J,Hillis D M. Phylogeny inference In:Hillis D M,Moritz B K(eds). Molecular systematics[M]. Sunderland:Sinauer Associates,1996:403-503.
[2]徐庆刚,花保祯.线粒体DNA在昆虫系统学研究中的应用[J].西北农林科技大学学报:自然科学版,2001,8:79-83
[3] Hebert P D N,Ratnasingham S,deWaard J R. Barcoding animal life:Cytochrome c oxidase subunit 1 pergences among closely related species[J]. Proceedings of the Royal Society of London series B:Biological Science,2003,270:S96-S99.
[4] Hajibabaei M,Singer G A,Hebert P D N. DNA barcoding:how it complements taxonomy,molecular phylogenetics and population genetics[J]. Trends in Genetics,2007,23(4):167-172.
[5] Frézal L,Leblois R. Four years of DNA barcoding:current advances and prospect[J]. Infection,Genetics and Evolution,2008,8:727-736.
[6] Galimberti A,De Mattia F,Losa A,et al DNA barcoding as a new tool for food traceability[J]. Food Research International,2013,50:55-63
[7]王德明,林杨.线粒体DNA基因序列在昆虫分子系统学研究中的应用[J].广东农业科学,2010,6:188-190.
[8]刘殿锋,蒋国芳.核基因序列在昆虫分子系统学上的应用[J].动物分类学报,2005,30(3):484-492.
[9] Chintauan-Marquier I C,Legendre, Frédéric,Hugel S,et al Laying the foundations of evolutionary and systematic studies in crickets(Insecta,Orthoptera):a multilocus phylogenetic analysis[J]. Cladistics-the International Journal of the Willi Hennig Society,2016,32(1):54-81.
[10] Chang Gyu-Dong,Lee Seon-Mi,Kim Jin-Hee,et al DNA Barcoding for Reveal a Possible New Species of Anurophorus(Collembola:Isotomidae)Associated with Korean Fir(Abies koreana Wilson)[J]. Journal of AsiaPacific Biopersity,2020.
[11] Ji Y,Yu X. Molecular test shows the color pattern is not so reliable in diagnostic of genus Dysphaea Selys(Odonata:Euphaeidae)[J]. Zoological Systematics,2019,44(2):91-99.
[12]郝桂英,杨光友,古小彬.基于线粒体COⅡ基因的33株细颈囊尾蚴分离株种系发育关系分析[J].中国兽医科学,2011,41(7):684-690.
[13]李芳芳,陈学新,朴美花,等.基于28SrRNA基因D2序列的优茧蜂亚科分子系统发育(膜翅目:茧蜂科)[J].昆虫分类学报,2003,25(3):217-226.
[14] Muccio T D,Marinucci M,Frusteri L,et al Phylogenetic analysis of Phlebotomus species belonging to the subgenus Larroussius(Diptera,Psychodidae)by ITS2 rDNA sequences[J]. Insect Biochemistry and Molecular Biology,2000,30(5):387-393.
[15] Sima Y H,Chen M,Yao R,et al The complete mitochondrial genome of the Ailanthus silkmoth,Samia cynthia cynthia(Lepidoptera:Saturniidae)[J]. Gene,2013,,526(2).
[16]叶碧欢,李海波,叶卫邦,等.锈色粒肩天牛幼虫的COⅠ、COⅡ、Cytb和28S基因片段序列分析[J].浙江农林大学学报,2020,37(2):303-310.
[17]呼晓庆,杨兆富.基于线粒体COⅠ、Cytb和COⅡ基因的中国草地螟不同地理种群遗传分化分析[J].昆虫学报,2019,62(6):720-733.
[18]魏久锋.中国圆盾蚧亚科分类研究(半翅目:盾蚧科)[D].杨凌:西北农林科技大学,2011.
[19]刘殿锋.应用18S rDNA和16S rDNA序列研究蝗总科昆虫的系统进化[D].南京:南京师范大学,2005.
[20] Dawnay N,Ogden R,Mcewing R,et al Validation of the barcoding gene COⅠfor use in forensic genetic species identification[J]. Forensic ence International,2007,173(1):1-6.
[21]晏毓晨,李泽建,黎桂鸿,等.危害短梗稠李的中国丑锤角叶蜂属(膜翅目:锤角叶蜂科)一新种[J].林业科学,2020,56(5):105-112.
[22]张鹏飞,周晓榕,庞保平,等.基于线粒体COⅠ基因序列的内蒙古沙葱萤叶甲种群遗传多样性及遗传分化[J].环境昆虫学报,2017,39(2):332-341.
[23]聂跃,卢塘飞,陈俊谕,等.基于COⅠ基因的橡胶树六点始叶螨遗传多样性分析[J].热带作物学报,2020,41(4):773-778.
[24]常虹,郝德君,肖荣堂,等.基于线粒体COⅠ基因的齿小蠹属昆虫DNA条形码研究[J].昆虫学报,2012,55(9):1075-1081.
[25]代金霞,张大治.叶甲亚科部分种类COⅡ基因序列分析及系统发育初探[J].四川动物,2010,29(2):193-196.
[26] Lydeard C,Roe K J. The phylogenetic utility of the mitochondrial Cytochrome b gene for inferring relationships among actinopterygian fishes.[M]//Kocher T D,Stepien C Aed. Molecular Systematic of Fish. Academic Press,NewYork,1997,285-303.
[27]傅美兰,彭建军,王莹,等. DNA条形码技术的应用与分析[J].河南师范大学学报,2010,38(4):118-122.
[28] Rortais A,Arnold G,Alburaki M,et al Review of the DraI COⅠ-COⅡtest for the conservation of the black honeybee(Apis mellifera mellifera)[J]. Conservation Genetics Resources,2011,3:383-391.
[29] Krosch M N,Schutze M K,Armstrong K F,et al A molecular phylogeny for the Tribe Dacini(Diptera:Tephritidae):Systematic and biogeographic implications[J].Molecular Phylogenetics and Evolution,2012,64(3):513-523.
[30]谭文静.基于线粒体COⅠ、COⅡ基因的云南省横坑切梢小蠹种群遗传结构研究[D].昆明:云南大学,2019.
[31] Kimura M. A simple method for estimating evolutionary rate of base substitutions through comparative studies of nucleotide sequence[J]. Journal of Molecular Evolution,1980,16:111-120.
[32] Sperling F A H,Raske A G,Otvos I S. Mitochondrial DNA sequence variation among populations and host races of Lambdina fiscellaria(Gn)(Lepidoptera:Geometridae)[J]. Insect Molecular Biology,1999,8:97-106.
[33]季英华,史文琦,乐文静,等.不同地理种群灰飞虱基于COⅡ基因的系统发育分析[J].江苏农业学报,2010,26(3):499-502.
[34] Meyer A,Wilson A C. Origin of tetrapods inferred from their mitochondrial DNA affiliation to lungfish[J]. Journal of Molecular Evolution,1990,31(5):359-364.
[35]杨瑞生,顾羽健,陈玉波,等.柞蚕饰腹寄蝇基于线粒体Cytb基因的种群变异及系统进化分析[J].蚕业科学,2019,45(4):509-516.
[36] Gilarriortua M,Salona Bordas M I,CainéLaura M,et al Cytochrome b as a useful tool for the identification of blowflies of forensic interest(Diptera,Calliphoridae)[J].Forensic Science International,2013,228(1-3):132-136.
[37]戴金霞.线粒体Cytb基因与昆虫分子系统学研究[J].四川动物. 2005,24(2):222-225.
[38] Teixeira G A,Barros,Luísa Ant?nia Campos,De Aguiar H J A C,et al Comparative physical mapping of 18S rDNA in the karyotypes of six leafcutter ant species of the genera Atta and Acromyrmex(Formicidae:Myrmicinae)[J]. Genetica,2017,145(4-5).
[39]贾晨曦.我国北方金龟科甲虫分子标记和系统发育研究[D].沈阳:沈阳大学,2014.
[40] Coleman A W. ITS2 is a double-edged tool for eukaryote evolutionary comparisons[J]. Trends in Genetics,2003,19(7):370-375.
[41]白映禄,薛玉丽,常芸,等.基于rDNA ITS1序列的甘肃省叶螨属Tetranychus和全爪螨属Panonychus种群的系统关系[J].甘肃农业大学学报,2019,54(5):128-134.
[42]杜周和.基于Bmamy2基因的家蚕起源与分化研究[D].重庆:西南大学,2009.
[43]田嵩浩,赵慧婷,姜玉锁.基于核基因EF-1α的中国境内东方蜜蜂遗传分化[J].泉州师范学院学报,2016,34(6):22-26.
[44]尚北晨.基于mtDNA COⅠ和ND5基因的香梨优斑螟种群遗传结构研究[D].阿拉尔:塔里木大学,2018.
[45] Leavitt J R,Hiatt K D,Whiting M F,et al Searching for the optimal data partitioning strategy in mitochondrial phylogenomics:A phylogeny of Acridoidea(Insecta:Orthoptera:Caelifera)as a case study[J]. Molecular Phylogenetics&Evolution,2013,67(2):494-508.





