摘 要: 概述了阳离子表面活性剂、阴离子表面活性剂和生物表面活性剂的抑菌机理及应用, 其中重点介绍了抑菌型生物表面活性剂的应用, 并对表面活性剂在抑菌领域的发展趋势提出了展望。
关键词: 表面活性剂; 抑菌机理; 应用;
Abstract: The antimicrobial mechanisms and applications of cationic surfactants, anionic surfactants and biosurfactants were summarized.The applications of biosurfactants were mainly introduced and the trends of surfactants in the antibacterial field were prospected.
Keyword: surfactant; antimicrobial mechanism; application;
表面活性剂的抑菌作用早为人熟知, 但将其作为抑菌剂的时间却不长。抑菌型表面活性剂最大的特点是同时利用其表面活性和抑菌性, 在界面处发生定向吸附从而大大提高抑菌效果。理想的抑菌型表面活性剂应具有抑菌谱广、抑菌性能强、作用时间短、用量少、毒性小、生物降解性好、性质稳定等特点。在实际应用中, 大多数抑菌型表面活性剂能达到选择性抑菌效果, 但抑菌谱较窄。目前使用最广泛的抑菌型表面活性剂是阳离子表面活性剂, 如苯扎溴铵 (新洁尔灭) 。近年来, 随着科学技术的不断深入研究和人们环保意识的不断加强, 表面活性剂的抑菌应用研究越来越多, 但在抑菌型表面活性剂的抑菌机理和抑菌应用方面的结论较少。本文主要介绍了阳离子表面活性剂、阴离子表面活性剂和生物表面活性剂的抑菌机理及应用研究的最新进展。
1、 不同表面活性剂的抑菌机理
抑菌剂是指在一定时间内能够杀灭或抑制微生物生长的一类化合物。细胞要维持正常的生命活动, 必须进行能量代谢与物质代谢, 这就为抑菌剂提供了攻击目标。抑菌剂可分为能量合成抑制剂和生物合成抑制剂。细胞呼吸是一个复杂的过程, 能量合成抑制剂是通过抑制其中的某一环节来限制细胞生长, 从而达到抑菌效果。生物合成抑制剂是抑制细胞生长和维持生命活动所需要的新物质产生的过程, 因此和能量合成抑制剂不同, 它关系到生物合成流动源的物质。生物合成抑制剂有多种, 可通过抑制细胞壁 (若存在) 、细胞膜、核酸、蛋白质的合成来达到抑制作用。常见的表面活性剂是与细胞膜发生作用来起到抑菌作用。细胞膜是一种选择性透过膜, 有着重要的生理功能, 它既能使细胞维持稳定代谢的胞内环境, 又能调节和选择物质进出细胞。所以任何对细胞膜的选择性和渗透性造成影响的因素都会对微生物造成伤害, 从而达到抑菌或杀菌的效果。1935年, Domark首先发现了表面活性剂具有杀菌、抑菌的作用, 之后Wetzel进行了临床消毒实验, 目前此类抑菌剂已经发展到第5代。我国在1964年研发出一种季铵盐类化合物———苯扎溴铵 (新洁尔灭) , 它具有良好的杀菌作用。1971年国家药检所对其进行进一步研究并推荐其作为消毒剂使用。此后表面活性剂的抑菌、杀菌作用逐渐受到大家的重视和应用。
1.1、 阳离子表面活性剂抑菌机理
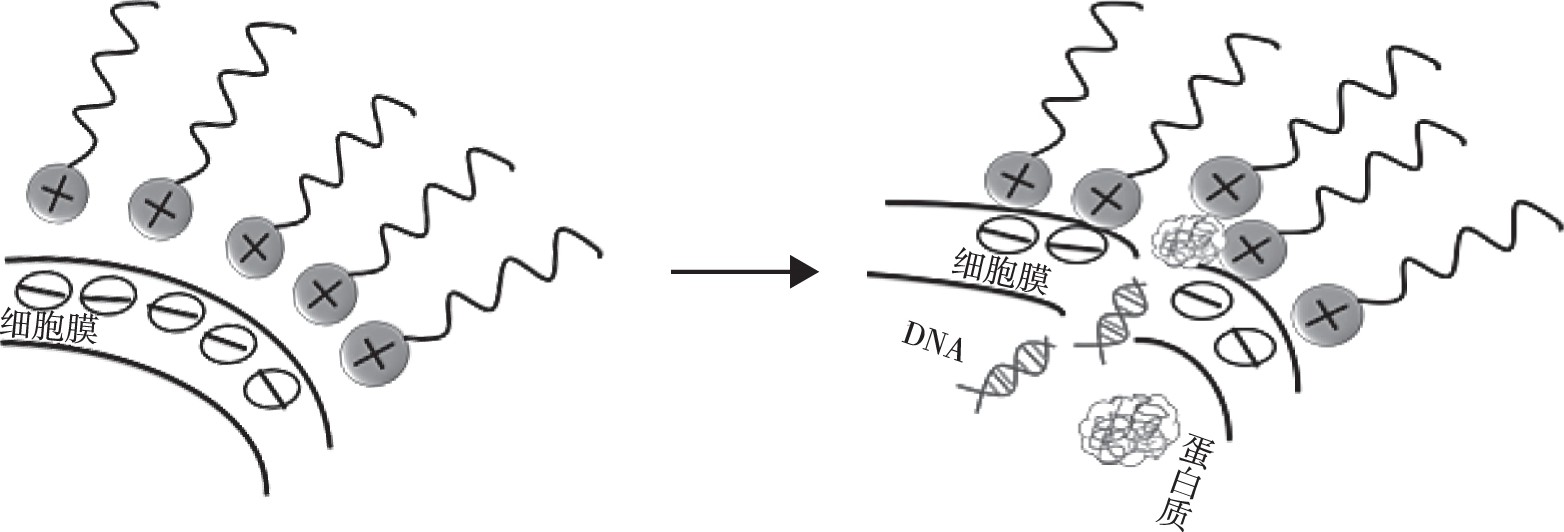
表面活性剂通过静电作用和疏水作用吸附在菌体表面, 改变细胞膜的通透性和细胞的渗透压, 导致细胞内容物流出, 微生物发生接触死亡。同时, 表面活性剂与细胞内蛋白结合, 使酶和蛋白变性, 破坏细胞代谢[1,2]。由于细胞膜的主要化学成分脂多糖、脂质双分子层、脂蛋白及其他分子基团使得细胞表面带有负电荷并具有疏水特性, 所以此机理发生于阳离子表面活性剂和菌体之间, 如图1所示。早在1968年, Salton[3]总结了阳离子表面活性剂与细菌结合的主要过程:首先表面活性剂吸附到细菌表面, 通过孔隙渗透到细胞壁, 然后表面活性剂与细胞膜发生静电作用和疏水作用使细胞结构破坏, 导致细胞内的物质流出, 同时表面活性剂和细胞内的蛋白质和核酸结合并使之降解, 最后自溶酶破坏细胞壁。张山山[4]采用光密度 (OD) 法测定了12种季铵盐双子表面活性剂和2种传统单子表面活性剂 (DTAB和CTAB) 对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度 (MIC) 。实验结果表明双子表面活性剂比传统的单子表面活性剂具有更高的抑菌活性。一方面, 这是由于季铵盐双子表面活性剂通常带有2个单位的正电荷, 更容易吸附在菌体表面。另一方面, 它含有2条疏水碳链, 因此更容易深入到细胞膜的类脂层和蛋白层, 不仅增加细胞膜的疏水性还会在细胞膜上形成瞬时通道。表面活性剂的表面活性和抗微生物活性存在一定的关系[5], 适当地增加阳离子表面活性剂的疏水端的长度, 即在空气/水界面处的表面活性剂分子量增加, 使得有效作用于微生物细胞膜上的群体增加, 导致抑菌效果更加明显。
图1 阳离子表面活性剂抑菌机理Fig.1 Antimicrobial mechanism of cationic surfactants
1.2、 阴离子表面活性剂抑菌机理
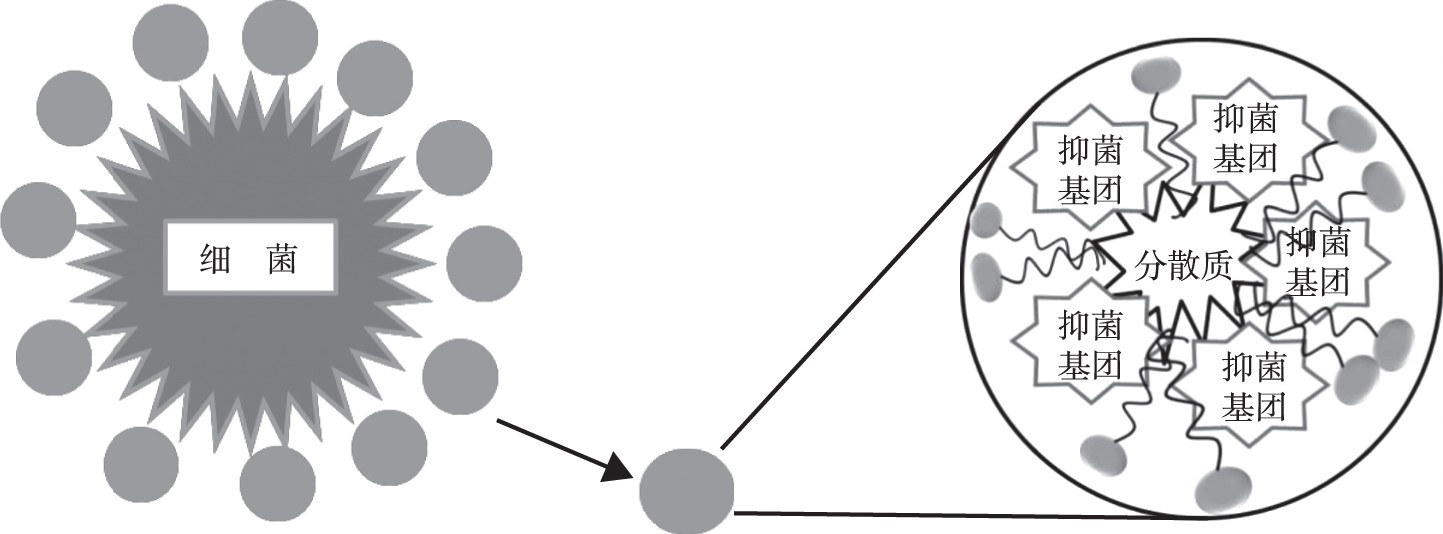
目前已知的抑菌型阴离子表面活性剂较少, 关于其抑菌机理的叙述尚不明确, 传统型的阴离子表面活性剂是由疏水性部分 (各种长度的烷基链、烷基苯基醚、烷基苯等) 和亲水性部分 (羧基、硫酸盐、磺酸盐、磷酸盐等) 组成的化合物。据相关报道[6], 阴离子表面活性剂与细胞的结合较少, 大多数含有阴离子的分子仍然保留在水基介质中, 可能是以不溶单分子层或扩散的形式存在。疏水链的长度不是抑菌作用的主要贡献者, 但在引发活性中起重要作用。传统型的阴离子表面活性剂的抑菌效果不明显, 大部分合成的新型阴离子表面活性剂存在一定的抑菌作用, 主要是其携带的抑菌基团的性质决定了抑菌性能, 表面活性剂起到了增溶和扩散的作用, 并且在亲水基团相同的情况下, 表面活性剂随着碳链长度的增长, 其润湿性能和吸附能力大大提高, 表现出的抑菌效果更为明显。在某种特殊的体系中, 如胶体溶液中, 亲水基团与水溶性的分散剂结合, 疏水链会与疏水性的分散质颗粒通过定向吸附而紧密结合, 通过这种方式将两相界面转化为致密的分子界面膜。同时, 抑菌基团会在分散质颗粒附近表面形成一层保护层从而抑制细菌的生长, 如图2所示。菅丰田等[7,8]利用脂肪胺 (包括正己胺、正辛胺和正十二胺) 、氨基乙磺酸、2-氨基苯并咪唑为原料合成了3种具备抑菌性的含三嗪环阴离子型表面活性剂, 发现其在天然胶乳、涂料等胶体中有一定的杀菌作用, 并且研究者做了关于未携带抑菌基团的表面活性剂和携带抑菌基团的表面活性剂的抑菌对比实验, 结果表明, 未携带抑菌基团的表面活性剂对试验菌 (大肠杆菌和金黄色葡萄球菌) 没有明显的抑制作用。由此可以看出, 阴离子表面活性剂的抑菌机理与阳离子表面活性剂的抑菌机理有着根本性的不同, 阴离子表面活性剂的抑菌作用和所处的溶液体系以及表面活性剂自身所带的抑菌基团等因素有关, 所以此类表面活性剂作为杀菌剂会受到一定的限制, 特别是在胶体体系中, 此类表面活性剂必须达到足够的添加剂量, 使得体系的每个角落都有表面活性剂的存在, 才能产生良好的微生物杀灭作用。表面活性剂对目标物的保护部位缺乏针对性, 对其集中发挥杀菌作用的位点缺乏定位, 不仅造成没有必要的浪费, 长时间使用还会产生抗药性。
图2 阴离子表面活性剂抑菌机理Fig.2 Antimicrobial mechanism of anionic surfactants
1.3、 生物表面活性剂抑菌机理
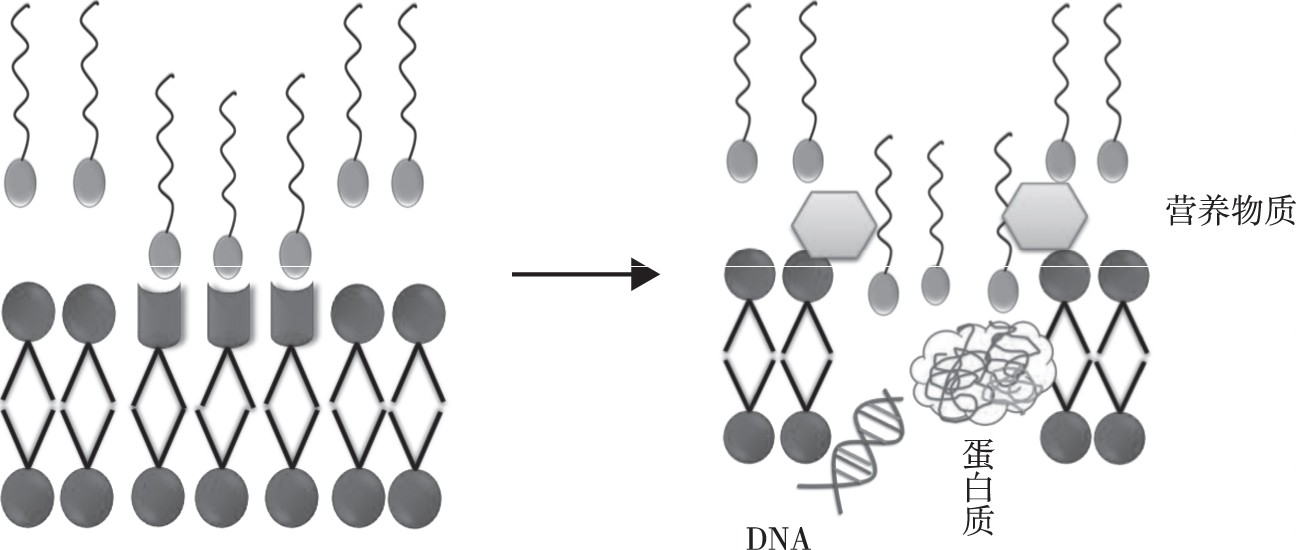
生物表面活性剂是指微生物在代谢过程中分泌出的具有一定表面活性的代谢产物, 如糖脂、脂肽、脂肪酸、磷脂和中性类脂衍生物等。同一种菌的不同菌株能产生几种不同的表面活性剂, 而且即使同一种菌株产生的同一种表面活性剂, 也不是纯的单分子化合物, 这些类似物在结构上存在差别, 同时碳链的长度及支链位置也不相同。目前, 对生物表面活性剂的抑菌机理还没有明确的概述, 被广为接受的一种解释是细胞膜上含有大量磷脂, 依据分子的亲和性, 生物表面活性剂可以与之结合, 当达到一定的浓度时, 会产生“去垢剂”的效果, 改变细胞膜的通透性, 形成孔隙和离子通道, 影响营养物质的运输和气体交换, 使得内容物外流, 最终导致菌体死亡[9,10], 如图3所示。一些生物表面活性剂还具有抗菌、抗病毒、抗肿瘤、抗癌等药理作用和免疫功能。
图3 生物表面活性剂抑菌机理Fig.3 Antimicrobial mechanism of biosurfactants
2、 抑菌应用
随着越来越多的具有抑菌性能的表面活性剂被开发, 其应用领域在不断扩展, 市场需求在逐步增加, 也推动了表面活性剂的创新和发展。
2.1、 阳离子表面活性剂抑菌应用
目前已知的表面活性剂中, 阳离子型表面活性剂的抑菌性能利用得最为广泛, 特别是季铵盐类阳离子表面活性剂表现出很强的杀菌作用。季铵盐类表面活性剂的这种性质, 常用于原油开采、水产养殖、纺织、造纸、医药、建筑材料、皮革、木材等领域的杀菌消毒。孙保兴等[11]利用癸甲丙二醇氯铵季铵盐与碘络合配制成杀菌剂, 即双星座溴化双阳离子表面活性剂, 并对水产养殖场、养鸡场进行了杀菌试验。结果表明所制备的杀菌剂毒性低、杀灭病毒效果优良, 是一种有广泛应用前景的新型消毒杀菌剂。Diz等[12]合成了一种新的季铵盐类表面活性剂N-十二烷基-N, N-二甲基甘氨酰半胱氨酸盐酸盐 (DABM) 。DABM可以通过其巯基与羊毛相连, 使羊毛产品对短小芽孢杆菌和金黄色葡萄球菌有抑菌活性。AEGIS Environments公司[13]用季铵盐类表面活性剂制成一种商品抗菌纺织品BIOGUARD, 这种表面活性剂为N-十八烷基-N, N-二甲基[3- (三甲氧基硅基) 丙基]盐酸盐 (AEM5700, 以前称为道康宁5700抗菌剂) , 对革兰氏阳性菌和革兰氏阴性菌的MIC为10~100 mg/L。苗宗成等[14]使用十二烷基二甲胺和环氧氯丙烷为反应原料制备了一种新型的双阳离子季铵盐表面活性剂, 发现这种表面活性剂对纸张中的大肠杆菌和金黄色葡萄球菌有杀灭作用。杨保平等[15]以具有抗菌性的功能单体丙烯酰氧乙基二甲基乙基溴化铵 (PEDAB) 与甲基丙烯酸甲酯、甲基丙烯酸丁酯及丙烯酸丁酯自由基聚合, 配制合成丙烯酸抗菌涂料。抗菌性检测结果表明在合成树脂过程中功能单体的用量为8%, 涂膜对金黄色葡萄球菌、大肠杆菌、绿脓杆菌及黑曲霉的抗菌率均达到99%。黄忠林等[16]合成了一种新的阳离子表面活性剂对羟基苯甲酸酯季铵盐, 该表面活性剂用于皮革防霉实验中结果表明:随着表面活性用量增加, 防霉效果增加明显, 质量分数为2.0%时抑菌圈直径达到5.83 cm。Rajkowska等[17]的实验结果表明十二烷基二甲基氯化铵 (DDAC) 对历史木材中的荧光假单胞菌、蜡状芽孢杆菌、球毛壳菌和青霉菌有良好的杀灭作用。Tantawy等[18]从废弃油脂中提取脂肪酸, 合成的脂肪酰胺与不同的烷基卤化物和硫酸二甲酯反应形成所需的阳离子表面活性剂, 合成的新型阳离子表面活性剂对大肠杆菌、金黄色葡萄球菌、黄曲霉菌、白色念珠菌均有良好的抑制作用, 其中3-烷基酰胺-N, N, N-三甲基硫酸酯-1-丙胺由于其结构中存在硫酸盐基团, 其抑菌圈直径达到13~27 mm, 表现出比参考值更高的活性。Migahed等[19]合成了一系列的含有酯键的双季阳离子表面活性剂, 杀灭微生物活性数据表明, 合成的表面活性剂能有效杀灭金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌、烟曲霉菌和白色念珠菌, 并且随着表面活性剂分子的疏水链长的增加, 这些表面活性剂作为杀生物剂的效力逐渐增强。Aiad等[20]将3-二甲氨基-1-丙胺 (DMAPA) 与苯甲醛通过缩合反应合成席夫碱, 并与不同的脂肪烷基溴如癸基溴、十二烷基溴和十六烷基溴生成阳离子表面活性剂。这些阳离子表面活性剂对短小芽孢杆菌、藤黄微球菌、黄色链霉菌、白色念珠菌和黄青霉菌均具有明显的抗微生物活性。严宝等[21]合成了一系列阳离子双子表面活性剂, 实验结果表明它们对大肠杆菌、金黄色葡萄球菌和黄曲霉菌均有良好的抑制效果。阳离子双子表面活性剂具有比传统的阳离子单体表面活性剂更高的疏水性, 可以增强表面活性剂在细菌细胞膜表面的吸附。Taleb等[22]合成了新型酰胺基阳离子双子表面活性剂, 抑菌实验结果表明其对金黄色葡萄球菌、大肠杆菌和白色念珠菌均有显着的抑制作用, 同时根据MIC和最小致死浓度 (MLC) 可以发现将疏水链长度从8增加到12个碳原子时, 表面活性剂对金黄色葡萄球菌的抑制作用随之增强。除此之外, 具有抑菌性能的阳离子型表面活性剂还有咪唑鎓盐类、吡啶鎓盐类、异喹啉鎓盐类等。Garcia等[23]合成了2种含酯基的咪唑鎓溴盐离子液体和吡啶鎓溴盐离子液体表面活性剂, 并发现该离子液体表面活性剂对金黄色葡萄球菌、大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌和白色念珠菌均有一定的杀灭作用。吡啶鎓盐是以吡啶与烷基卤化物反应制得的, 常见的具有抑菌性能的此类表面活性剂有氯化十六烷基吡啶铵、氯化十七酰甲胺基吡啶铵、氯化十二烷基吡啶铵、氯化苄基吡啶铵等。烷基异喹啉盐型阳离子表面活性剂为良好的杀菌剂, 可配入洗护用品中。
2.2、 阴离子表面活性剂抑菌应用
阴离子表面活性剂是表面活性剂中发展历史最悠久、产品种类最多、产量最大的一类产品, 它是个人洗护用品和洗涤用品的主要活性成分, 同时在诸多工业领域也有广泛应用。由于其分子结构本身的特点, 阴离子表面活性剂的抑菌效果远不如阳离子表面活性剂, 相关应用也较少。N-酰基氨基酸阴离子表面活性剂是为数不多的具有抑菌性能的阴离子表面活性剂, 在合成此类表面活性剂中所用到的氨基酸主要有肌氨酸、谷氨酸、α-氨基丁二酸、丝氨酸、丙氨酸、亮氨酸等。所用到的脂肪酸有月桂酸、油酸、椰子油酸、棕榈油酸、硬脂肪酸、辛酸、癸酸等。目前, 该类表面活性剂的生产规模小, 主要应用在食品、化妆品和个人卫生用品等领域。最近几年, 对合成的新型阴离子表面活性剂的抑菌方面的研究在逐年增加。Negm等[24]用4种脂肪醇 (辛醇、十二烷醇、十六烷醇和十八烷醇) 与磷酸发生酯化反应, 生成的化合物与聚乙二醇反应, 用氢氧化钠淬灭化合物, 生成了一些阴离子双子表面活性剂。通过抑菌圈实验结果表明合成的阴离子表面活性剂对短小芽孢杆菌、藤黄微球菌、假单胞菌、绿色假丝酵母菌、大肠杆菌、白色念珠菌和黄青霉菌均显示出良好的抗微生物活性。Reddy等[25]利用来自蓖麻油和棕榈油的脂肪醇和乳酸合成了一系列具有乳酸头基的阴离子表面活性剂, 研究显示它们能抑制金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、白色念珠菌和植生克雷伯菌的生长。El-Shahawi等[26]设计并合成了一组含有氧代哒嗪酮基团的新型阴离子表面活性剂, 它们对蜡状芽孢杆菌、大肠杆菌、黑曲霉和白色念珠菌均有良好的抑制作用, 并且抑菌性能的增加可归因于烷基链长度的增加以及氧代哒嗪酮基团的存在。
2.3、 生物表面活性剂抑菌应用
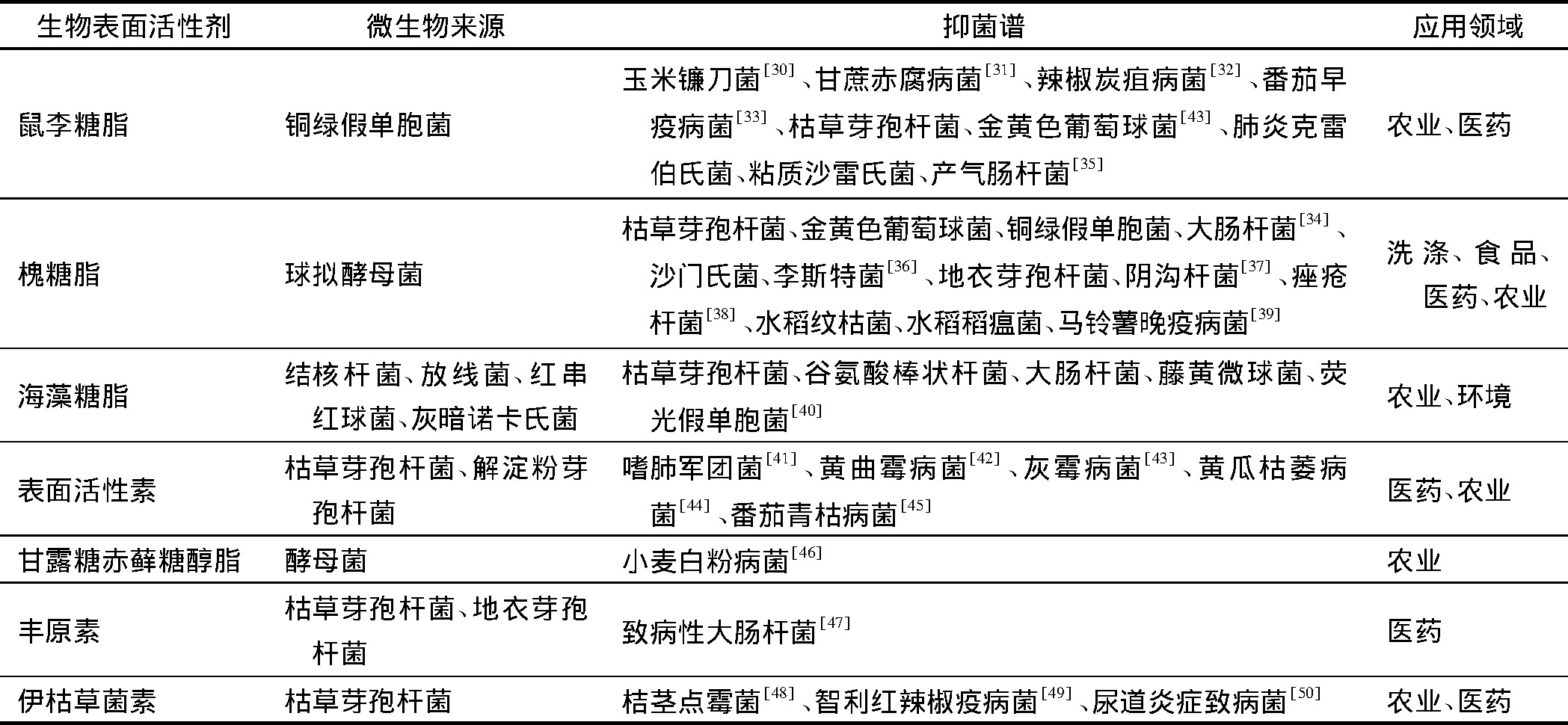
生物表面活性剂具有低毒性、抑菌性、生物可降解性及生物相容性等优点, 但其存在成本较高和产量较低等缺陷, 使得生物表面活性剂在应用上受到很大的限制。目前, 生物表面活性剂的抑菌杀菌性能主要应用在医药、农业、食品等领域。Sambanthamoorthy等[27]发现詹氏乳杆菌和鼠李糖乳杆菌产生的生物表面活性剂对大肠杆菌和金黄色葡萄球菌有明显的抗菌活性。Mehta等[28]的研究结果表明, 作为枯草芽孢杆菌株的代谢物脂肽类生物表面活性剂, 它能够抑制多种革兰氏阳性菌的活性。Mani等[29]发现一种产自海洋腐生葡萄球菌SBPS15的糖脂, 这种糖脂对很多人类致病细菌和临床分离真菌菌株具有拮抗作用。2003年, 首支用于临床治疗革兰氏阳性菌引起的复杂皮肤感染和结构性皮肤感染的环脂肽新药Daptomycin先后在美国、德国、英国和荷兰上市。表1列举了抑菌型生物表面活性剂及其应用领域。
表1 抑菌型生物表面活性剂及其应用领域Tab.1 Biosurfactants and their antimicrobial application fields
3、 结束语
表面活性剂因特有的抑菌性能, 使其成为一种重要的抑菌剂。随着人们对环境友好型和多功能型的表面活性剂的不断深入研究, 表面活性剂在抑菌领域的应用将更为广泛, 也将推动抑菌剂向更多元化方向发展。为了进一步深入和拓展表面活性剂在抑菌领域应用, 更好地满足该领域的发展, 需要有目的地开展以下工作:
1) 设计新型表面活性剂分子结构
利用统计学和生物信息学, 有目的性地选择分子元件进行产品设计和开发, 如选择特定的抑菌基团和阴离子表面活性剂结合来达到特定的抑菌效果。
2) 提升表面活性剂生物降解性
大部分表面活性剂在使用后, 都会排放到自然环境中。如果表面活性剂没有生物降解属性, 就会长期存在于自然界水系统中, 影响生态环境。开发原料易得、对环境友好、可生物降解的天然及改性表面活性剂产品迫在眉睫。
3) 优化表面活性剂配伍
复合杀菌剂与单一杀菌剂相比, 延长了使用周期, 且化学性质稳定、腐蚀性小、受有机物和水的硬度影响小。利用表面活性剂复配协同效应, 研制安全、高效的表面活性剂复配产品, 也是表面活性剂在抑菌应用研究中的重要发展方向。
参考文献:
[1]Tawfik S M, Abd-Elaal A A, Shaban S M, et al.Surface, thermodynamic and biological activities of some synthesized gemini quaternary ammonium salts based on polyethylene glycol[J].Journal of Industrial&Engineering Chemistry, 2015, 30:112-119.
[2]Zhang S, Ding S, Yu J, et al.Antibacterial activity, in vitro cytotoxicity and cell cycle arrest of Gemini quaternary ammonium surfactants[J].Langmuir the Acs Journal of Surfaces&Colloids, 2015, 31 (44) :12161-12169
[3]Salton M R.Lytic agents, cell permeability, and monolayer penetrability[J].Journal of General Physiology, 1968, 52 (52) :227-252.
[4]Zhang Shanshan.Study on micellization properties, interface activity and chemical biology of quaternary ammonium gemini surfactants[D].Hangzhou:Zhejiang University, 2016.
[5]Cakmak I, Ulukanli Z, Tuzcu M, et al.Synthesis and characterization of novel antimicrobial cationic polyelectrolytes[J].European Polymer Journal, 2004, 40 (10) :2373-2379.
[6]Tawfik S M, Zaky M F, Mohammad T G M, et al.Synthesis, characterization, and in vitro, antifungal activity of anionic and nonionic surfactants against crop pathogenic fungi[J].Journal of Industrial&Engineering Chemistry, 2015, 29 (8) :163-171.
[7]Jian Fengtian, Hu Zhiyong, Jiang Xinxin, et al.Study on the relationship between antibacterial activity and surface activity of novel antibacterial active anionic surfactants[J].Guangdong Chemical Industry, 2014, 41 (3) :18-19.
[8]Jian Fengtian, Hu Zhiyong, Jiang Xinxin, et al.The application of novel antibacterial anionic surfactants in the short-term storage of fresh natural latex[J].Guangdong Chemical Industry, 2014, 41 (5) :21-22.
[9]Cao Xiaohong, Liao Zhenyu, Wang Chunling, et al.Purification and antimicrobial activity of lipopeptide produced by bacillus natto TK-1and its surfactant property[J].Chinese Journal of Biological Engineering, 2008, 28 (1) :44-48.
[10]Hsieh F C, Li M C, Lin T C, et al.Rapid detection and characterization of surfactin-producing Bacillus subtilis and closely related species based on PCR[J].Current Microbiology, 2004, 49 (3) :186-191.
[11]Sun Baoxing, Zheng Cheng, Wei Xingchuan.Synthesis of the bromide gemini cationic surfactant and its applications as disinfector[J].Guangzhou Chemical Industry, 2008, 36 (2) :1-5.
[12]Diz M, Infante M R, Erra P, et al.Antimicrobial activity of wool treated with a new thiol cationic surfactant[J].Textile Research Journal, 2016, 71 (8) :695-700.
[13]Ye Jinxing.The latest development of textile antibacterial finishing[J].Modern Textile Technology, 2010, 18 (6) :59-63.
[14]Miao Zongcheng, Wang Lei, Wang Dengwu, et al.Application of novel gemini quaternary ammonium salt as paper bacteriostatic agent[J].Papper and Papermaking, 2012, 31 (8) :57-59.
[15]Yang Baoping, Tan Sheng, Guo Junhong, et al.Development of acrylic antibacterial coatings[J].Coating Industry, 2011, 41 (8) :43-45.
[16]Huang Zhonglin, Tang Yi, Yang Lu, et al.Synthesis of paraben quaternary ammonium salt surfactant and its anti-mold properties[J].Western Leather, 2010, 32 (1) :13-15.
[17]Rajkowska K, Koziróg A, Otlewska A, et al.Quaternary ammonium biocides as antimicrobial agents protecting historical wood and brick[J].Acta Biochimica Polonica, 2016, 63 (1) :153-159.
[18]Tantawy A H, Abo-Riya M A, Abdallah S M, et al.Novel cationic surfactants based on waste frying oil for cleaning water surface from petroleum films:Synthesis, antimicrobial and surface properties[J].Journal of Molecular Liquids, 2018, 253:36-44.
[19]Migahed M A, Negm N A, Shaban M M, et al.Synthesis, characterization, surface and biological activity of diquaternary cationic surfactants containing ester linkage[J].Journal of Surfactants&Detergents, 2016, 19 (1) :119-128.
[20]Aiad I, Elsukkary M M, Soliman E A, et al.Characterization, surface properties and biological activity of new prepared cationic surfactants[J].Journal of Industrial&Engineering Chemistry, 2014, 20 (4) :1633-1640.
[21]Yan Bao, Guo J, Ma J, et al.Physicochemical and antimicrobial activities of cationic gemini surfactants with polyether siloxane linked group[J].Journal of Molecular Liquids, 2017, 242:8-15.
[22]Taleb K, Mohamed-Benkada M, Benhamed N, et al.Benzene ring containing cationic gemini surfactants:Synthesis, surface properties and antibacterial activity[J].Journal of Molecular Liquids, 2017, 241:81-90.
[23]Garcia M T, Ribosa I, Perez L, et al.Aggregation behavior and antimicrobial activity of ester-functionalized imidazolium-andpyridiniumbased ionic liquids in aqueous solution[J].Langmuir, 2013, 29 (8) :2536-2545.
[24]Negm N A, Tawfik S M.Characterization, surface properties and biological activity of some synthesized anionic surfactants[J].Journal of Industrial&Engineering Chemistry, 2014, 20 (6) :4463-4472.
[25]Reddy Y S, Sujitha P, Kumar C G, et al.Synthesis and evaluation of surface and biological properties of some lactic acid-based anionic surfactants[J].Journal of Surfactants&Detergents, 2016, 19 (2) :1-9.
[26]El-Shahawi M M, Shalaby A A S, Gabre E D, et al.Surface active properties and biological activities of novel anionic surfactant based on oxapyridazinone derivatives[J].Journal of Surfactants&Detergents, 2016, 19 (1) :137-144.
[27]Sambanthamoorthy K, Feng X, Patel R, et al.Antimicrobial and antibiofilm potential of biosurfactants isolated from lactobacilli against multi-drug-resistant pathogens[J].BMC Microbiology, 2014, 14 (1) :197.
[28]Mehta A, Mirshekar-Syahkal D, Nakano H.Effect of fengycin, a lipopeptide produced by bacillus subtilis, on model biomembranes[J].Biophysical Journal, 2008, 94 (7) :2667-2679.
[29]Mani P, Dineshkumar G, Jayaseelan T, et al.Antimicrobial activities of a promising glycolipid biosurfactant from a novel marine Staphylococcus saprophyticus, SBPS 15[J].Biotech, 2016, 6 (2) :163.
[30]Borah S N, Goswami D, Sarma H K, et al.Rhamnolipid biosurfactant against Fusarium verticillioides to control stalk and ear rot disease of maize[J].Frontiers in Microbiology, 2016, 7:1501.
[31]Goswami D, Borah S N, Lahkar J, et al.Antifungal properties of rhamnolipid produced by Pseudomonas aeruginosa DS9 against Colletotrichum falcatum[J].Journal of Basic Microbiology, 2015, 55 (11) :1265-1274.
[32]Lahkar J, Goswami D, Deka S, et al.Novel approaches for application of biosurfactant produced by Pseudomonas aeruginosa, for biocontrol of Colletotrichum capsici, responsible for anthracnose disease in chilli[J].European Journal of Plant Pathology, 2018, 150 (1) :1-15.
[33]Lahkar J, Borah S N, Deka S, et al.Biosurfactant of Pseudomonas aeruginosa, JS29 against Alternaria solani:the causal organism of early blight of tomato[J].Biocontrol, 2015, 60 (3) :401-411.
[34]Rienzo M A D D, Stevenson P, Marchant R, et al.Antibacterial properties of biosurfactants against selected gram positive and negative bacteria[J].FEMS Microbiol Lett, 2016, 363 (2) :224.
[35]Haba E, Pinazo A, Jauregui O, et al.Physicochemical characterization and antimicrobial properties of rhamnolipids produced by Pseudomonas aeruginosa 47 T2 NCBIM 40044[J].Biotechnology&Bioengineering, 2003, 81 (3) :316-322.
[36]Zhang X J, Ashby R, Solaiman D, et al.Inactivation of Salmonella spp.and Listeria spp.by palmitic stearic and oleic acid sophorolipids and thiamine dilauryl sulfat[J].Frontiers in Microbiology, 2016 (7) :2076.
[37]Solaiman D, Ashby R D, Birbir M, et al.Antibacterial activity of sophorolipids produced by Candida bombicola on gram-positive and gramnegative bacteria isolated from salted hides[J].Journal of the American Leather Chemists Association, 2016, 111 (10) :358-364.
[38]Solaiman D, Ashby R D, Crocker N V.High-titer production and strong antimicrobial activity of sophorolipids from rhodotorula bogoriensis[J].Biotechnology Progress, 2015, 31 (4) :867-874.
[39]Fu Shengmi.Antimicrobial activity of sophorolipids against phytopathogenic fungi and the development of new biopesticides[D].Jinan:Qilu University of Technology, 2014.
[40]Kuyukina M S, Ivshina I B, Korshunova I O, et al.Diverse effects of a biosurfactant from Rhodococcus ruber IEGM 231 on the adhesion of resting and growing bacteria to polystyrene[J].AMB Express, 2016, 6 (1) :14.
[41]Loiseau C, Schlusselhuber M, Bigot R, et al.Surfactin from bacillus subtilis displays an unexpected anti-legionella activity[J].Applied Microbiology and Biotechnology, 2015, 99 (12) :5083-5093.
[42]Farzaneh M, Shi Z Q, Ahmadzadeh M, et al.Inhibition of the Aspergillus flavus growth and aflatoxin B1 contamination on pistachio nut by fengycin and surfact in-producing Bacillus subtilis UTBSP1[J].Plant Pathology Journal, 2016, 32 (3) :209-215.
[43]Tanaka K, Amaki Y, Ishihara A, et al.Synergistic effects of surfact in homologues with bacillomycin D in suppression of gray mold disease by Bacillus amyloliquefaciens biocontrol strain sd-32[J].Journal of Agricultural&Food Chemistry, 2015, 63 (22) :5344-5353.
[44]Jia K, Gao Y H, Huang X Q, et al.Rhizosphere inhibition of cucumber fusarium wilt by different surfactin-excreting strains of bacillus subtilis[J].Plant Pathology Journal, 2015, 31 (2) :140.
[45]Xiong H, Li Y, Cai Y, et al.Isolation of Bacillus amyloliquefaciens jk6and identification of its lipopeptides surfactin for suppressing tomato bacterial wilt[J].Rsc Advances, 2015, 5 (100) :82042-82049.
[46]Yoshida S, Koitabashi M, Nakamura J, et al.Effects of biosurfactants, mannosylerythritol lipids, on the hydrophobicity of solid surfaces and infection behaviours of plant pathogenic fungi[J].Journal of Applied Microbiology, 2015, 119 (1) :215-224.
[47]Rivardo F, Turner R J, Allegrone G, et al.Anti-adhesion activity of two biosurfactants produced by Bacillus spp.prevents biofilm formation of human bacterial pathogens[J].Applied Microbiology&Biotechnology, 2009, 83 (3) :541.
[48]Kalai-Grami L, Karkouch I, Naili O, et al.Production and identification of iturin A lipopeptide from Bacillus methyltrophicus TEB1 for control of Phoma tracheiphila[J].Journal of Basic Microbiology, 2016, 56 (8) :864-871.
[49]Park K, Park Y S, Ahamed J, et al.Elicitation of induced systemic resistance of chili pepper by iturin A[J].Canadian Journal of Plant Science, 2016, 96 (4) :564-570.
[50]Bernat P, Paraszkiewicz K, Siewiera P, et al.Lipid composition in a strain of Bacillus subtilis, a producer of iturin a lipopeptides that are active against uropathogenic bacteria[J].World Journal of Microbiology&Biotechnology, 2016, 32 (10) :157.





